题目内容
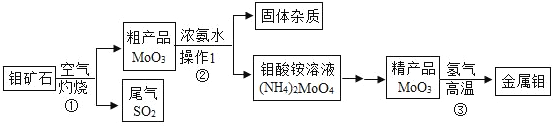
【题目】SrCl2·6H2O具有很高的经济价值,以工业碳酸锶(SrCO3质量分数为98.5%,极少量Ba2+,微量Fe2+)为原料制备SrCl2·6H2O的工艺流程如下:
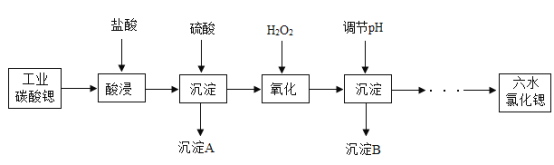
已知:
①SrCl2难溶于酒精,SrCl2·6H2O在61.5℃会失去结晶水,生成SrCl2·2H2O。
②降温结晶速率太快,会导致晶体细碎,夹带溶液,导致晶体不纯。
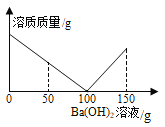
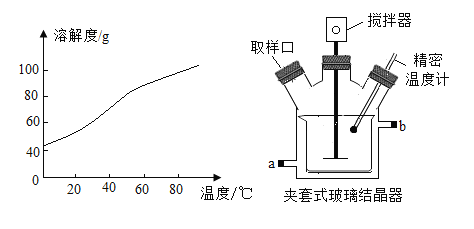
③SrCl2溶解度曲线及结晶装置图如下:
(1)酸浸时,搅拌的作用是____。发生反应的化学方程式主要为____,属于____反应(填基本反应类型)。能否用稀硫酸代替稀盐酸,__(填“能”或“否”)理由是___。
(2)沉淀A为____(填化学式),沉淀B为红褐色,是____(填化学式)。调节pH时,最好选用的试剂是____。
A NaOH
B Ca(OH)2
C Sr(OH)2
(3)流程中,“……”为一系列操作,分别为蒸发浓缩→____→过滤→洗涤→烘干。实验室完成过滤操作所需的玻璃仪器有烧杯、玻璃棒、____。夹套式玻璃结晶器的夹套内是冷却水,可由外接计算机程序精确控制进水的温度,进水口为____(填“a”或“b”)。
(4)洗涤SrCl2·6H2O晶体适宜选用的试剂是____。
A 0℃时蒸馏水
B 常温SrCl2饱和溶液
C 热水
D 无水酒精
(5)SrCl2·6H2O晶体烘干的适宜温度为___。
A 50 ~ 60℃
B 70 ~ 80℃
C 80 ~ 100℃
D 100℃以上
(6)常用锶转化率衡量工艺水准,本工艺使用100吨工业碳酸锶,最终得到176.9吨SrCl2·6H2O,则本工艺中的锶转化率约为___。(精确到小数点后一位)
【答案】使反应物充分接触,反应更快更充分 ![]() 复分解 否 因为要制备SrCl2·6H2O,使用稀硫酸会引入杂质硫酸根离子 BaSO4 Fe(OH)3 C 冷却结晶 漏斗 a B A 99.5%
复分解 否 因为要制备SrCl2·6H2O,使用稀硫酸会引入杂质硫酸根离子 BaSO4 Fe(OH)3 C 冷却结晶 漏斗 a B A 99.5%
【解析】
(1)酸浸时,搅拌的作用是使反应物充分接触,反应更快更充分。发生反应的化学方程式主要为![]() ,具有两种化合物交换成分生成另外两种化合物,属于复分解反应。不能用稀硫酸代替稀盐酸,填否,理由是:因为要制备SrCl2·6H2O,使用稀硫酸会引入杂质硫酸根离子。
,具有两种化合物交换成分生成另外两种化合物,属于复分解反应。不能用稀硫酸代替稀盐酸,填否,理由是:因为要制备SrCl2·6H2O,使用稀硫酸会引入杂质硫酸根离子。
(2)钡离子和硫酸根离子结合成硫酸钡沉淀,沉淀A为BaSO4,沉淀B为红褐色的氢氧化铁,化学式为Fe(OH)3)。调节pH时,最好选用的试剂是Sr(OH)2,以免引入钠离子和钙离子。
故选C。
(3)流程中,“……”为一系列操作,分别为蒸发浓缩→冷却结晶→过滤→洗涤→烘干。实验室完成过滤操作所需的玻璃仪器有烧杯、玻璃棒、漏斗。夹套式玻璃结晶器的夹套内是冷却水,可由外接计算机程序精确控制进水的温度,进水口为a,有利于充满装置,冷却效果好。
(4)洗涤SrCl2·6H2O晶体适宜选用的试剂是:常温SrCl2饱和溶液,以免晶体损失。
故选B。
(5)SrCl2·6H2O在61.5℃会失去结晶水,生成SrCl2·2H2O。SrCl2·6H2O晶体烘干的适宜温度为50 ~ 60℃,不超过61.5℃。
故选A。
(6)常用锶转化率衡量工艺水准,本工艺使用100吨工业碳酸锶,最终得到176.9吨SrCl2·6H2O,则本工艺中的锶转化率约为
![]() ,
,![]()
![]() 。
。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】探究铜生锈的条件
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
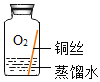
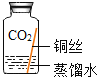
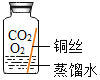
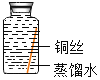
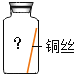
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与O2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验①和③,得出的结论是_____。
(4)为验证猜想,实验⑤广口瓶中除铜丝外,还应有的物质是_____。
(5)由上述实验可推知,铜生锈的条件是_____。
(反思与应用)
(6)结合上述实验,你对保存铜制品的建议是_____。
【题目】在一个密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量/g | 0 | 12 | 15 | 待测 |
已知X的对分子质量为n,Q的相对分子质量为2n。下列推理正确的是( )
A.反应后Q的质量为12g
B.该化学方程式中X与Q的化学计量数之比为2:3
C.反应后生成15gZ
D.反应中Y与Q发生改变的质量比为1:1