题目内容
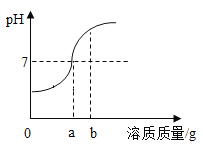
【题目】如图为甲、乙两物质的溶解度曲线,下列说法正确的是( )
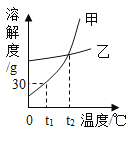
A.甲的溶解度大于乙的溶解度
B.t2℃时,甲、乙的饱和溶液中溶质的质量相等
C.t1℃时,将30g甲物质放入50g水中,得到溶液的质量为80g
D.t2℃时,甲、乙的饱和溶液分别恒温蒸发100g水,析出晶体的质量相等
【答案】D
【解析】
A、溶解度的比较应指明温度,否则无法比较,不符合题意;
B、由图可知,t2℃时,甲、乙的溶解度曲线相交,说明该温度下,甲、乙的溶解度相等,故该温度下,甲、乙的饱和溶液的溶质质量分数相等,因为没有指明等质量的饱和溶液,所以溶质质量无法比较,不符合题意;
C、由图可知,t1℃时,甲物质的溶解度为30g,即该温度下,100g水中最多能溶解30g甲物质,将30g甲物质放入50g水中,得到溶液的质量:15g+50g=65g,不是80g,不符合题意;
D、t2℃时,甲、乙的饱和溶液分别恒温蒸发100g水,析出晶体的质量相等正确,因为它们在该温度下的溶解度相等,符合题意。
故选D。

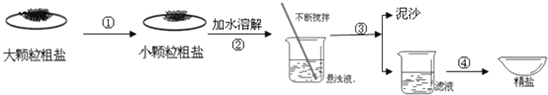
【题目】小明在家里的月饼包装盒中发现一包袋装防腐剂,品名为“504双吸剂”,其标签如图所示,同学们对这包久置的“504双吸剂”固体样品很好奇,设计实验进行探究
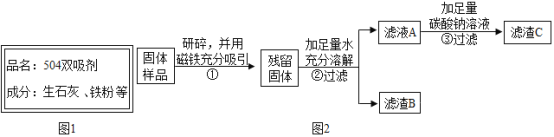
(提出问题)久置固体的成分是什么?
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
(实验探究)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体于试管中,滴加足量的__. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有__,一定不含Fe2O3 |
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是__.他设计图2所示实验方案继续探究.
(1)步骤①样品用磁铁吸引前需经过研碎处理,研碎的目的是__.
(2)步骤②中固体溶解时放出大量的热,由此可判断原固体中一定含有__.
(3)步骤③中反应的化学方程式是__.
(4)乙同学对滤渣B进一步探究.取少量滤渣B于试管中,滴加足量的稀盐酸,并将产生的气体通入澄清石灰水中,观察到固体逐渐消失、有气泡产生、溶液变成黄色、澄清石灰水变浑浊,由此得出结论,原固体中一定含有__.
(5)丙同学认为乙同学的实验还无法确定原固体中是否含有Ca(OH)2,他的理由是__.
【题目】下表列出了KNO3在不同温度下的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
(1)由上表可推出KNO3溶解度曲线的变化规律是______。
(2)20℃时,把40gKNO3放入小烧杯中,然后再加100g水不断搅拌,形成溶液的质量为____g;该溶液是___(填“饱和”或“不饱和”)溶液。
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是____(填序号)。
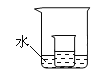
①浓硫酸 ②硝酸铵 ③氢氧化钠 ④冰