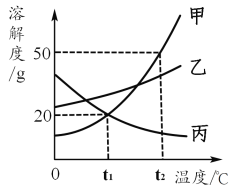
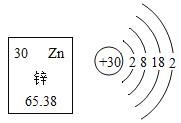
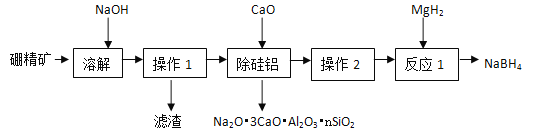
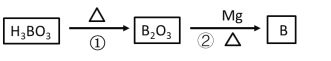题目内容
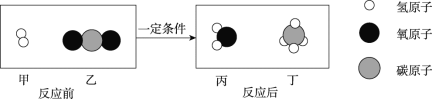
【题目】A~H,A是一种盐,且碳元素的质量分数是12%,其他都是初中化学常见物质,如图为这些物质的相互转化关系图。其中E为黑色固体,H为蓝色色沉淀,其中部分生成物与反应条件已省略。
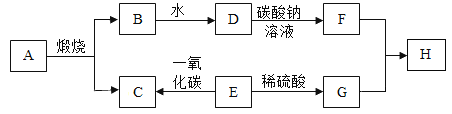
(1)H的化学式是_____。
(2)D的俗名是_____。
(3)写出E→G的化学方程式_____。
【答案】Cu(OH)2 熟石灰 CuO+H2SO4═CuSO4+H2O
【解析】
如图为这些物质的相互转化关系图,已知碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,因此A是碳酸钙,B是氧化钙,C是二氧化碳,D是氢氧化钙,F是氢氧化钠;其中E为黑色固体,H为一种不溶于水的蓝色固体,氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,氧化铜和硫酸反应生成硫酸铜和水,硫酸铜和氢氧化钠反应生成氢氧化铜蓝色沉淀和硫酸钠,因此E是氧化铜,G是硫酸铜,H是氢氧化铜。代入检验,符合题意。
(1)根据分析,H的化学式是Cu(OH)2;
(2)根据分析,D是氢氧化钙,俗名是熟石灰;
(3)氧化铜和硫酸反应生成硫酸铜和水,故化学方程式为:CuO+H2SO4═CuSO4+H2O;
故答案为:
(1)Cu(OH)2;(2)熟石灰;(3)CuO+H2SO4═CuSO4+H2O;

【题目】复方氢氧化镁片[有效成分Mg(OH)2]和复方碳酸镁片[有效成分MgCO3]是两种常见的抗胃酸药。从A或B中任选一个作答,若均作答,按A计分。
A | B |
(1)Mg(OH)2的相对分子质量为___________。 (2)用复方碳酸镁片治疗胃酸过多症时,反应的化学方程式为_____________。 | (1)MgCO3中氧元素质量分数的计算式为___________。 (2)用复方氢氧化镁片治疗胃酸过多症时,反应的化学方程式为__________。 |
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.

提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
实验探究:
甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体放于试管中,滴加足量的_____. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有_____, 一定不含Fe2O3. |
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____.并设计如下实验方案继续验证.
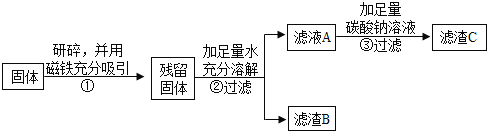
(1)②中固体溶解时放出大量热,由此可以判断固体中一定含有_____.
(2)③中反应的化学方程式是_____.
乙同学对滤渣B又进行探究.
实验操作 | 实验现象 | 实验结论 |
_____ | _____ | 固体中一定含有CaCO3 和Fe2O3. |
丙同学认为乙同学的方案中仍有一种物质不能确定.丙同学经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g.
综合上述实验及所给数据,久置固体的成分是_____.