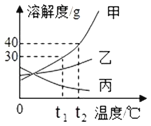
题目内容
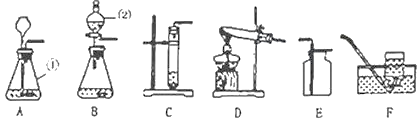
【题目】实验室部分仪器或装置如下图所示,请回答下列问题。

(1)实验室常用石灰石和稀盐酸制取二氧化碳气体,发生装置可选择图中的_____,(填仪器字母)进行组装,检查气密性的方法是(所需仪器自选)_____,反应的化学方程式为_____。
(2)采用上述方法制取的二氧化碳中常含有氯化氢气体和水蒸气。为获得纯净、干燥的二氧化碳气体,可选用下图所示的H装置和I装置进行除杂和干燥,导管口连接的正确顺序是:气体→_____→F。(查阅资料:浓硫酸是干燥剂,能吸收气体中含有的水蒸气;(NaHCO3+HCl=NaCl+CO2↑+H2O)
(3)为了防止制取的CO2中含有盐酸挥发出的HCl气体,_____。(填“能”或“不能”)用没有挥发性的稀硫酸代替稀盐酸,原因是_____。
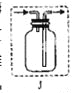
(4)实验室也可用上述发生装置制取氢气,若用图所示J装置采用“排空气法”收集氢气,请在图中将导管补画完整_____。
【答案】(1)ABD(1分)将出气口堵住,从长颈漏斗中注入水,如液面保持平稳,则证明气密性良好。(合理即可)(2分) CaCO3+2HCl═CaCl2+H2O+CO2↑(2分)
(2)cdab(2分)
(3)不能 生成的硫酸钙附着在石灰石的表面,阻止反应进一步进行。(各一分)
(4)(2分)
【解析】
试题(1)实验室常用石灰石和稀盐酸制取二氧化碳气体,发生装置可选择图中的ABD三个仪器连接。A为反应仪器,B为加液体药品的仪器;D为导气仪器。 检查气密性的方法是:将出气口堵住,从长颈漏斗中注入水,如液面保持平稳,则证明气密性良好。或者可以先从长颈漏斗中注入水至浸没漏斗未端,再将出气口浸入水中,用双手捂住锥形瓶,如水中有气泡冒出,则证明气密性良好。石灰石和稀盐酸为:CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)除去氯化氢气体和水蒸气时,应注意先除去氯化氢气体再除去水。可利用碳酸氢钠能与氯化氢的水溶液盐酸反应除去氯化氢气体;利用浓硫酸的吸水性除去水蒸气。如先用除去水再除去氯化氢,会造成气体从I装置中出来又带出来部分水蒸气,实验不成功。除杂时,要长进短出。所以导管口连接的正确顺序是cdab。
(3)不能,因为硫酸与碳酸反应会生成微溶的硫酸钙。当生成硫酸钙的量达到一定的量,会因溶解不了而从溶液中析出,覆盖在碳酸钙的表面。从而造成反应停止。
(4)氢气的密度比空气小,适用于向下排空气法。所以应让J装置符合短进长出。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体同时产生无色无味气体。兴趣小组同学进行了以下探究。

实验1:向5份相同体积的硫酸铜溶液中分别加入表面经过打磨处理的相同长度的铝条,现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向质量分数为8%的硫酸铜溶液分别加入表面经过打磨处理的相同长度的铝条,现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ |
水浴温度(℃) | 20 | 30 | 40 | 50 | 60 |
气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |
(1)实验1的目的是______。
(2)实验2的结论是______。
(3)依据实验1和实验2,推测50℃ 5% 硫酸铜溶液与铝条反应的现象是________。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是_______。
(5)根据你的猜想,气泡中的气体是______。
【题目】(3分)有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将一定量的石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量 /g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量 /g | 35.2 | 58.4 | 82.6 | 107.6 |
求:(1)第1次加入稀盐酸充分反应后,生成二氧化碳的质量是 g。
(2)该石灰石样品中碳酸钙的质量分数。