题目内容
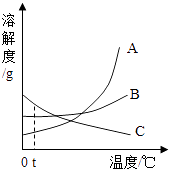
【题目】下表为KCl、NaCl和KNO3在不同温度时的溶解度,如图为它们的溶解度曲线. 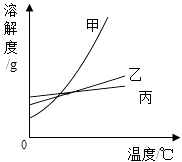
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | KCl | 34.0 | 37.0 | 42.6 | 45.5 | 51.1 |
NaCl | 36.0 | 36.3 | 37.0 | 37.3 | 38.4 | |
KNO3 | 31.6 | 45.8 | 85.5 | 110.0 | 169.0 | |
(1)30℃时,KCl的溶解度为 .
(2)如图中表示KNO3溶解度曲线的是(填“甲”、“乙”或“丙”).
(3)30℃时,向45.8g KNO3固体中加入100g水,充分溶解后升温至40℃,该溶液中溶质的质量分数(填“变大”、“变小”或“不变”).
(4)要将丙的不饱和溶液转化为饱和溶液适宜的方法是 .
【答案】
(1)36.0g
(2)甲
(3)不变
(4)蒸发结晶
【解析】解:(1)根据表中的信息可确定 30℃时KCl的溶解度为37.0g;所以答案是36.0g(2)根据表中的信息可确定硝酸钾的溶解度随温度变化明显,而氯化钾的溶解度随温度变化很不明显,所以答案是:甲;(3)30℃时KNO3的溶解度为45.8g,100g水中最多溶解45.8g,向45.8g KNO3固体中加入100g水,恰好完全溶解,由于硝酸钾的溶解度随温度的升高而增大,升温至40℃,变为不饱和溶液,溶质质量和溶剂质量不变,该溶液中溶质的质量分数不变;(4)丙的溶解度随温度变化不大,将丙的不饱和溶液转化为饱和溶液适宜的方法是蒸发结晶. 答案:(1)36.0g(2)甲(3)不变(4)蒸发结晶
【考点精析】解答此题的关键在于理解饱和溶液和不饱和溶液相互转变的方法的相关知识,掌握饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂,以及对固体溶解度曲线及其作用的理解,了解1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

【题目】如表所列各组物质中,符合图示甲、乙、丙两两混合后发生反应的实验现象的是
甲 | 乙 | 丙 | |
① | 盐酸 | Na2CO3溶液 | Ca(OH)2溶液 |
② | 盐酸 | K2CO3溶液 | CaCl2溶液 |
③ | 盐酸 | K2CO3溶液 | Ba(OH)2溶液 |
④ | 盐酸 | Na2CO3溶液 | BaCl2溶液 |
( )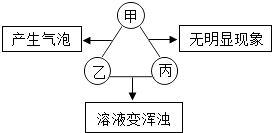
A.①②
B.③④
C.①③
D.①②③④
【题目】下表是100g某品牌板栗的部分营养成分.
总热量 | 蛋白质 | 糖类 | 油脂 | 钠 | 维生素C |
1016kJ | 5.1g | 11.3g | ? | 4.6mg | 3.3mg |
(1)食物的成分主要有六大类营养素,上表中没有涉及的营养素是 ;
(2)假设该板栗中的钠元素以氯化钠的形式存在,则100g该板栗中,氯化钠的质量为mg(计算最后结果精确到0.1,下同);
(3)假设食物的热量是由蛋白质、糖类、油脂提供的,单位质量的蛋白质、糖类、油脂完全氧化放热约为:油脂 39.3kJ/g 蛋白质 18kJ/g 糖类 15.6kJ/g.根据此数据计算,理论上100g该板栗中油脂的质量为g.