题目内容
【题目】已知某固体粉末是由 CaCl2、NaOH、K2CO3、Na2CO3、 NaCl中的一种或几种组成,取这种粉末 12g 加足量的水,振荡后呈浑浊,过滤、洗涤、烘干后得到 5g 沉淀和滤液。向滤液中滴加酚酞,变红;取少量滤液于试管中滴加硝酸银溶液有白色沉淀生成,再加入稀硝酸沉淀不消失且试管中有气泡产生。下列说法正确的是( )
A. 原固体中一定含 Na2CO3和CaCl2 ,可能含 K2CO3 和 NaCl
B. 滤液中一定含 NaCl 和 K2CO3,可能含 NaOH
C. 上述实验无法证明原固体中是否含 NaCl、CaCl2、NaOH
D. 原固体中一定含 CaCl2、NaOH 和 Na2CO3
【答案】A
【解析】设生成5g的碳酸钙沉淀需要氯化钙的质量为x,碳酸钾的质量为y
K2CO3+ CaCl2= CaCO3↓+2KCl
138 111 100
y x 5g
![]() =
=![]() =
=![]() ,解得x=5.55g,y=6.9g,5.55g+6.9g=12.45g,12.45g
,解得x=5.55g,y=6.9g,5.55g+6.9g=12.45g,12.45g![]() 12g,由于沉淀一定是碳酸钠和碳酸钾生成,如果只有碳酸钾质量已经超出12g,故原混合物中一定含有碳酸钠,可能含有碳酸钾;
12g,由于沉淀一定是碳酸钠和碳酸钾生成,如果只有碳酸钾质量已经超出12g,故原混合物中一定含有碳酸钠,可能含有碳酸钾;
几种物质中,只有钙离子和碳酸根离子可以生成沉淀,说明该物质中一定有氯化钙,向滤液中滴加酚酞,变红,说明反应后溶液显碱性,有可能是过量的碳酸钠或者碳酸钾,不能确定是氢氧化钠,取少量滤液于试管中滴加硝酸银溶液有白色沉淀生成,再加入稀硝酸沉淀不消失且试管中有气泡产生,说明溶液中有氯离子,氯离子可能是氯化钠中的氯离子,也可能是氯化钙中的氯离子。故化合物中一定有碳酸钠和氯化钙,可能有碳酸钾和氯化钠,综上所述一定存在的是氯化钙和碳酸钠,可能存在的是氯化钠碳酸钾和氢氧化钠。故选A。

【题目】氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度及其溶解度曲线如下:
温度(℃) | 10 | 20 | 40 | 60 | 80 | |
溶解度(g) | KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | |
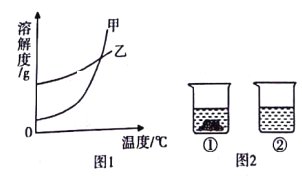
(1)图1中能表示KNO3溶解度曲线的是__________(填“甲"或“乙")。
(2)60℃时,将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是__________(填“饱和”或“不饱和”)溶液,其中溶质与溶剂的质量比为__________(填最简整数比)。
(3)20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加人100g水,充分溶解后,恢复至20℃,其结果如图2所示。下列有关说法中确的是__________(填字母)
A.烧杯①中溶解的是NaC1,烧杯2中溶解的是KNO3
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数一定减小