题目内容
【题目】实验课上,同学们发现一瓶久置空气中的氧化钠固体的瓶口有白色粉末。在老师指导下,同学们对该白色粉末的成分进行了讨论。
(猜想与假设) 猜想I:白色粉末是碳酸钠
猜想II:白色粉末是氢氧化钠
猜想III:白色粉末是_____________________
(查阅资料)CaCl2溶液,Ca(NO3)2溶液呈中性。
(实验探究)取白色粉末溶于水形成溶液A,设计如下实验:
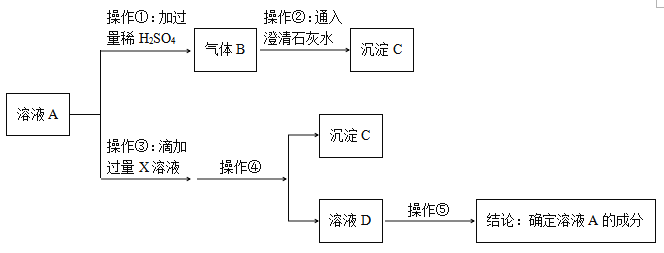
(1)由上述实验可知,猜想_______肯定不成立。
(2)若操作①滴加过量稀盐酸有气体B产生,而滴加少量稀硫酸可能没有气体B产生。其可能的原因是:_____________(用化学方程式回答)。
(3)适合操作③的X溶液是_______(填字母序号)。
A. CaCl2溶液 B. Ca(OH)2溶液 C. Ba(OH)2溶液 D. Ca(NO3)2溶液
(4)操作④需要用到的玻璃仪器是______________。
(5)请写出操作⑤的两种方案并得出结论。
方案一:________________________________________。
方案二:_________________。
【答案】 碳酸钠和氢氧化钠 Ⅱ 2NaOH+H2SO4═Na2SO4+2H2O AD 烧杯、漏斗、玻璃棒 滴加酚酞试液,酚酞试液变红色,说明溶液A中含有氢氧化钠 滴加氯化镁溶液,产生白色沉淀,说明溶液A中含有氢氧化钠
【解析】(1)该白色固体可能是碳酸钠、氢氧化钠,也可能是两者的混合物;操作①中加入过量的稀硫酸产生气体,该气体可以使澄清石灰水变浑浊,说明该气体是二氧化碳,则说明样品中含有碳酸钠,则猜想Ⅱ一定不正确;(2)操作①中滴加少量的稀硫酸,没有气泡产生,可能是硫酸先和氢氧化钠反应生成硫酸钠和水;(3)操作③中滴加过量X溶液的目的是为了将溶液中的碳酸钠完全除去同时生成中性的物质,防止后续对氢氧化钠的检验产生干扰,氯化钙和硝酸钙都可以将碳酸钠除去,同时生成中性的氯化钠和硝酸钠,而氢氧化钙、氢氧化钡则和碳酸钠反应生成碱性的氢氧化钠,不符合题意;(4)操作④是将沉淀和溶液进行分离,所以是过滤操作,所用到的玻璃仪器是烧杯、漏斗和玻璃棒;(5)操作⑤是想要检验溶液中是否含有氢氧化钠,可以用酸碱指示剂,也可以滴加能和碱反应生成沉淀的试剂。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根如据图所示装置完成实验,并按要求填写表格内容。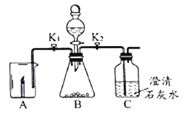
关闭K2打开K1A中现象 | B中发生反应化学方程式 | 解释A中现象 | 关闭K1打开K2C中现象 | 用化学方程式解释C中现象 |
蜡烛熄灭 | ______ | _____ | _____ | _____ |
蜡烛燃烧更旺 | _____ | ______ | _____ |