题目内容
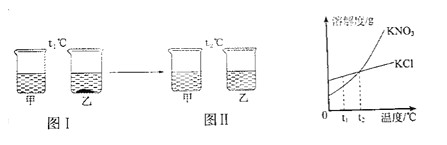
【题目】氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度及其溶解度曲线如下:
温度(℃) | 10 | 20 | 40 | 60 | 80 | |
溶解度(g) | KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | |
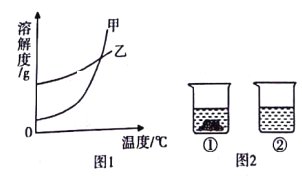
(1)图1中能表示KNO3溶解度曲线的是__________(填“甲"或“乙")。
(2)60℃时,将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是__________(填“饱和”或“不饱和”)溶液,其中溶质与溶剂的质量比为__________(填最简整数比)。
(3)20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加人100g水,充分溶解后,恢复至20℃,其结果如图2所示。下列有关说法中确的是__________(填字母)
A.烧杯①中溶解的是NaC1,烧杯2中溶解的是KNO3
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数一定减小
【答案】 甲 饱和 11:10 B
【解析】(1)根据溶解度表知道,在温度较低时,硝酸钾的溶解度较小,结合图中的两条溶解度曲线可以知道,甲表示的是硝酸钾的溶解度曲线。(2)60℃时,KNO3的溶解度是110g,则50g水中最多能溶解55g硝酸钾,所以将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是饱和溶液,其中溶质与溶剂的质量比为:55g:50g=11:10。(3)A.20℃时,NaCl的溶解度大于KNO3的溶解度,等质量的水中溶解的硝酸钾比氯化钠溶解的少,所以烧杯①中溶解的是硝酸钾,烧杯②中溶解的是氯化钠,错误;B.升高温度,硝酸钾的溶解度增大,所以升高温度或增加溶剂都有可能将烧杯①中固体全部溶解,正确;C.若将烧杯①中的溶液变为不饱和溶液,可以采用升高温度的方法,这样就会把不溶解的硝酸钾溶解,溶质质量分数会变大,错误。故选B。

 名校课堂系列答案
名校课堂系列答案【题目】甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现右图中箭头所示的转化。不符合上述要求的一组物质是
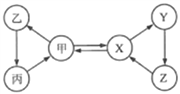
选项 | 甲 | X |
A | O2 | H2O |
B | CO2 | CaCO3 |
C | Fe | Fe3O4 |
D | NaOH | NaNO3 |
A. A B. B C. C D. D