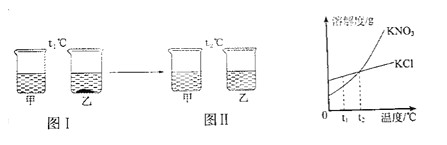
题目内容
【题目】向一定质量的5%的氢氧化钠溶液中加入66.9g硫酸铜溶液,恰好完全反应,得到4.9g蓝色沉淀。请计算:
(1)所用氢氧化钠溶液的质量________。
(2)反应后所得溶液的溶质质量分数__________。
【答案】 80g 5%
【解析】设参加反应的氢氧化钠的质量为x,反应生成硫酸钠的质量为y;
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
80 98 142
x 4.9g y
80/98=x/4.9g x= 4g
142/98=y/4.9g y=7.1g
氢氧化钠溶液的质量为:4g÷5%=80g
反应后所得溶液中溶质的质量分数是:
![]()
答:所用氢氧化钠溶液的质量80g;反应后所得溶液的溶质质量分数为5%。

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
【题目】根如据图所示装置完成实验,并按要求填写表格内容。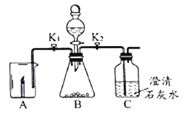
关闭K2打开K1A中现象 | B中发生反应化学方程式 | 解释A中现象 | 关闭K1打开K2C中现象 | 用化学方程式解释C中现象 |
蜡烛熄灭 | ______ | _____ | _____ | _____ |
蜡烛燃烧更旺 | _____ | ______ | _____ |