题目内容
某科研小组预测定孔雀石中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取30g该孔雀石样品放入烧杯中,再逐滴加入稀盐酸至恰好完全反应,反应的化学方程式为:铜Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O.共消耗该稀盐酸146g(假设杂质不与稀盐酸反应,也不溶于水),最终称得烧杯中剩余物质的质量为171.6g.试求:
(1)孔雀石中碱式碳酸铜的质量分数;
(2)所得溶液中溶质的质量分数.(结果保留至0.1%)
(1)孔雀石中碱式碳酸铜的质量分数;
(2)所得溶液中溶质的质量分数.(结果保留至0.1%)
试题分析:(1)依题意,CO2的质量=30g+146g﹣171.6g=4.4g
设孔雀石中碱式碳酸铜的质量为x,生成氯化铜质量为y
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 270 44
x y 4.4g
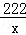 =
=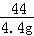 x=22.2g
x=22.2g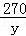 =
=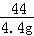 y=27g
y=27g∴孔雀石中碱式碳酸铜的质量分数为
 ×100%=74%
×100%=74%(2)根据(1)的计算可知,反应后溶液的质量=171.6g﹣(30g﹣22.2g)=163.8g
∴所得溶液中溶质的质量分数=
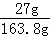 ×100%≈16.5%
×100%≈16.5%答:孔雀石中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目

