题目内容
【题目】某学习小组围绕“实验室制取气体”进行探究,请你参与完成下面的问题。
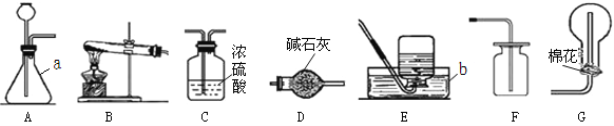
(1)写出图中所标仪器的名称a. ______;b. ______。
(2)若B装置中药品为紫黑色固体,则发生反应的化学方程式_______,此时B装置还需要改进的是______。实验室制取CO2可选用装置____和 _____组合,实验时长颈漏斗需______。
(3)实验室用加热氯化铵和熟石灰两种固体的混合物来制取氨气。氨气是一种无色、有刺激性气味的气体,极易溶于水,溶于水后显______(填“酸性”、“碱性”或“中性”)。
①写出实验室制取氨气的化学反应方程式______。
②实验室制取并收集干燥氨气,应选用的装置顺序为______(填字母)。
A.A—C—G B.B—D—E C.B—C—G D.B—D—G
【答案】 锥形瓶 水槽 2KMnO4![]() K2MnO4+MnO2+O2↑ 在试管口塞一团棉花 A F 伸到液面以下 碱性 2NH4Cl+ Ca(OH)2
K2MnO4+MnO2+O2↑ 在试管口塞一团棉花 A F 伸到液面以下 碱性 2NH4Cl+ Ca(OH)2 ![]() CaCl2+ 2H2O+ 2NH3↑ D
CaCl2+ 2H2O+ 2NH3↑ D
【解析】(1)根据仪器的结构可知仪器a为锥形瓶,b为水槽;
(2)若B装置中药品为紫黑色固体,应为高锰酸钾,加热分解生成氧气,则发生反应的化学方程式2KMnO4![]() K2MnO4+MnO2+O2↑,为防止少量高锰酸钾堵塞导管,此时B装置还需要改进的是在试管口塞一团棉花;实验室利用碳酸钙和稀盐酸制取CO2可选用装置A和 F组合,为防止CO2从长颈漏斗中逸出,实验时长颈漏斗需伸到液面以下;
K2MnO4+MnO2+O2↑,为防止少量高锰酸钾堵塞导管,此时B装置还需要改进的是在试管口塞一团棉花;实验室利用碳酸钙和稀盐酸制取CO2可选用装置A和 F组合,为防止CO2从长颈漏斗中逸出,实验时长颈漏斗需伸到液面以下;
(3)①加热氯化铵和熟石灰两种固体的混合物来制取氨气,同时生成氯化钙和水.反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②加热氯化铵和熟石灰两种固体的混合物来制取氨气,故发生装置选择B;氨气能溶于水,比空气的密度小,故收集装置选择G;装置顺序为B→D→G,故答案为D。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案