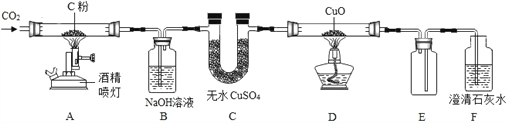
题目内容
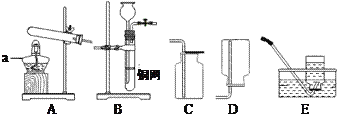
【题目】化学兴趣小组用以下装置探究炼铁的原理(根据需要酒精灯可加网罩)。
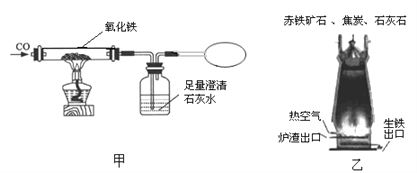
(1)乙图中高炉炼铁时焦炭的作用是_________。
(2)装置甲“炼”得的铁与装置乙炼出的生铁在组成上的最大区别是______。
(3)甲、乙两装置中共同发生的化学反应是__________(用化学方程式表示)
【答案】 燃烧提供热量;燃烧生成具有还原性的气体一氧化碳; 甲中炼得的铁不含碳,乙中炼得铁含有碳; Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
【解析】(1)乙图中高炉炼铁时,焦炭首先和氧气反应生成二氧化碳,同时放出大量的热;高温条件下,碳和二氧化碳反应生成还原剂一氧化碳,所以焦炭的作用是①燃烧提供热量;②燃烧生成具有还原性的气体一氧化碳;(2)装置甲“炼”得的铁与装置乙炼出的生铁在组成上的最大区别是甲中炼得的铁不含碳,因为原料只是氧化铁和一氧化碳;乙中炼得铁含有剩余的碳;(3)甲、乙两装置中共同发生的化学反应是氧化铁和一氧化碳高温条件下生成铁和二氧化碳,反应方程式为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。

【题目】善于提出问题、探究问题和解决问题是学好化学的重要法。某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究。
Ⅰ.提出问题:
问题1:铁有多种氧化物,它们的性质有哪些差异?
问题3:用一氧化碳还原氧化铁得到的黑色固体一定是单质铁吗?
Ⅱ.解决问题
【问题1】查询资料:
a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,可以被磁铁吸引。它不溶于水,可以近似地看作是氧化亚铁和氧化铁的化合物,能与酸反应生成两种盐。
C.氧化亚铁是不溶于水的黑色粉末,能与酸反应,无磁性,不能被磁铁吸引。
(1)请写出四氧化三铁与盐酸反应的化学方程式______________
(2)有一包黑色粉末,可能是铁粉、Fe3O4粉末、FeO粉末中的一种。请你设计一种实验方案进行鉴别。
实验步骤 | 实验现象及结论 |
步骤一:取少量样品用磁铁吸引 | 现象:_________________ |
步骤二:_________________ | _________________ |
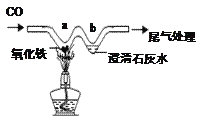
【问题2】同学们查阅资料得知CO与氧化铁反应,在不同的温度下,氧化铁因失氧程度不同而生成其他铁的氧化物(或铁单质)和CO2.小组同学设计了如图1所示的实验装置测定一氧化碳与氧化铁反应后的固体产物。
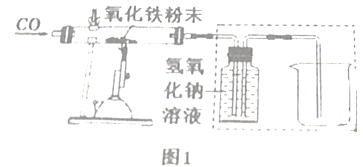
(3)实验开始应通入一氧化碳,再点燃酒精灯,目的是_________________________。
【注意】若答对以下问题奖励4分,化学试卷总分不超过60分。
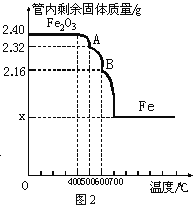
(4)同学们采集了用某种热分析仪记录的CO与氧化铁反应的有关数据,并得到固体质量与反应温度的关系曲线,如图2所示。根据相关信息,回答如下问题:
①图1虚线中装置的具体作用是____________________。
②在0~400℃温度范围内,管内固体质量不变,其原因是____________
③图中X=___________g,B点剩余固体的化学式是______________。
【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃ | 20 | 30 | 40 | 60 | 80 | 90 | 100 | |
溶解度 (g/100GH20) | NaCl | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.0 | 39.8 |
MgSO4 | 33.7 | 38.9 | 44.5 | 54.6 | 55.8 | 52.9 | 50.4 | |
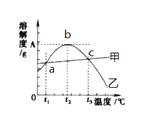
请回答下列问题:
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。