题目内容
【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃ | 20 | 30 | 40 | 60 | 80 | 90 | 100 | |
溶解度 (g/100GH20) | NaCl | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.0 | 39.8 |
MgSO4 | 33.7 | 38.9 | 44.5 | 54.6 | 55.8 | 52.9 | 50.4 | |
请回答下列问题:
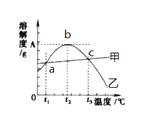
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。
【答案】 55.8g 氯化钠 20°C<t1<30°C 降温结晶 过滤析出的晶体 洗涤、烘干 26.8% 适当降温并加入MgSO4固体
【解析】(1)由溶解度表可知,80℃时,硫酸镁的溶解度为55.8g,从溶解度曲线可知,甲所代表的物质溶解度随温度的升高而增大,故甲是氯化钠。a点表示在某一温度时,氯化钠与硫酸镁的溶解度相等,根据溶解度表可知,两种物质溶解度相等对应的温度范围是20°C<t1<30°C。(2)由溶解度曲线看出,在0°C~t2℃范围内,硫酸镁的溶解度随温度的升高而增大,且受温度影响较大,而氯化钠的溶解度受温度影响不大,所以为了得到纯净的MgSO4,可用降温结晶法,然后将过滤析出的晶体洗涤、烘干。(3)40℃时,氯化钠的溶解度是36.6g,50g水中最多能溶解 18.3g氯化钠,所以把20g NaCl放入50g水中,形成的溶液中溶质质量分数为:![]() ×100%=26.8%。由t3℃时降温,硫酸镁的溶解度增大,所以要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是适当降温并加入MgSO4固体。
×100%=26.8%。由t3℃时降温,硫酸镁的溶解度增大,所以要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是适当降温并加入MgSO4固体。

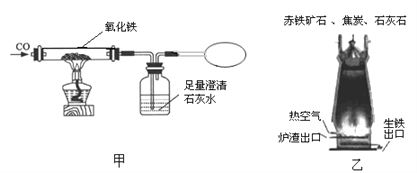
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
I.气体制备
(1)二氧化碳气体制备
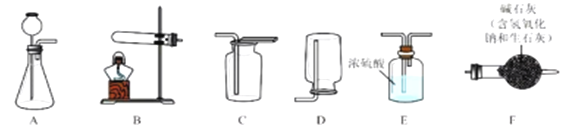
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。
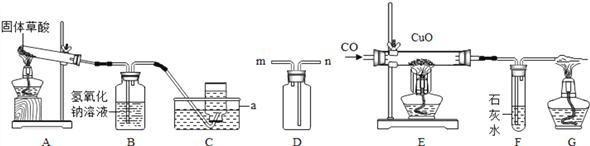
【题目】实验室利用不同的装置制取得到不同的气体。下图是实验室制取气体的各种装置。
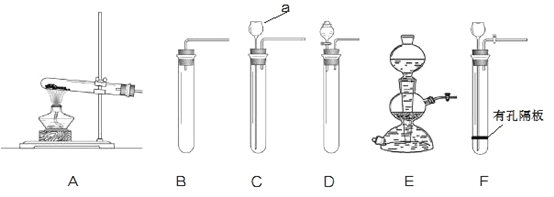
①图中仪器“a”的名称是______。制取气体的装置,放入药品前,均需对装置进 行______检查。
②上述装置按照不同角度可以分为两类,完成表格空白处:
分类依据 | 装置编号 | |
反应条件 | 加热 | A |
不加热 | BCDEF | |
(3) | 固体与固体 | A |
固体与液体 | BCDEF | |
若将“BCDEF”继续分为两类:“BCD”和“EF”两类,“EF”放在一起的理由是:________。
③如果实验室利用氯化铵固体与氢氧化钙固体在加热条件下得到氨气,选用的装置可以是______(选填图中装置编号);实验室利用大理石与稀盐酸反应制取 CO2,若要得到较 多的气体,装置宜选用_______(选填图中装置编号)。
④实验室利用大理石与稀盐酸反应制取 CO2,反应中共消耗了 3.65%的稀盐酸 100g,计算该 盐酸溶液中含 HCl 的物质的量是多少?可以得到 CO2 气体的质量是多少________?(请列式计算)
(7)计算 HCl 的物质的量:_______
(8)计算 CO2 气体的质量:________。