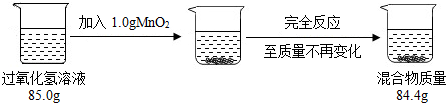
题目内容
硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用.取8.5%的过氧化氢溶液80g倒入小烧杯中,向其中加入未知浓度的硫酸铜溶液10.0g,使过氧化氢完全分解.计算:
(1)产生氧气的质量是多少?
(2)向反应后所得溶液中加入足量NaOH溶液,得到蓝色沉淀,过滤后随即进行称量(其他操作全正确),称得沉淀的质量为0.98g,请计算未知浓度的硫酸铜溶液的质量分数.
(1)产生氧气的质量是多少?
(2)向反应后所得溶液中加入足量NaOH溶液,得到蓝色沉淀,过滤后随即进行称量(其他操作全正确),称得沉淀的质量为0.98g,请计算未知浓度的硫酸铜溶液的质量分数.
(1)设产生氧气的质量为x,
2H2O2
2H2O+O2↑,
6832
80g×8.5% x
=
,
x=3.2g,
答:产生氧气的质量是3.2g.
(2)设硫酸铜的质量为y,
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,
16098
y 0.98g
=
,
y=1.6g,
硫酸铜溶液的质量分数为:
×100%=16%,
答:硫酸铜溶液的质量分数为16%
2H2O2
| ||
6832
80g×8.5% x
| 68 |
| 32 |
| 80g×8.5% |
| x |
x=3.2g,
答:产生氧气的质量是3.2g.
(2)设硫酸铜的质量为y,
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,
16098
y 0.98g
| 160 |
| 98 |
| y |
| 0.98g |
y=1.6g,
硫酸铜溶液的质量分数为:
| 1.6g |
| 10.0g |
答:硫酸铜溶液的质量分数为16%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目