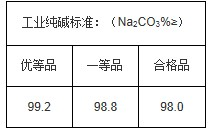
题目内容
由Mg、Cu组成混合物14.5g跟一定量的30%的稀硫酸恰好完全反应,除去水分后,得到24.1g固体物质(不含结晶水),则在化学反应中,生成氢气的质量为______g,消耗30%的稀硫酸的质量约为______g(保留一位小数).
因为恰好完全反应,所以除去水分后的固体即为MgSO4和Cu,根据质量守恒定律可以知道,和镁离子结合的硫酸根离子的质量为:24.1g-14.5g=9.6g,可据此求出MgSO4的质量为:9.6g÷
×10%=12g;
设生成氢气的质量为x,反应消耗的硫酸的质量为y
Mg+H2SO4═MgSO4+H2↑
98120 2
y 12g x
=
=
解得:x=0.2g,y=9.8g
所以消耗30%的稀硫酸的质量为:9.8g÷30%=32.7g
故答案为:0.2;32.7.
| 32+16×3 |
| 24+32+16×3 |
设生成氢气的质量为x,反应消耗的硫酸的质量为y
Mg+H2SO4═MgSO4+H2↑
98120 2
y 12g x
| 98 |
| y |
| 2 |
| x |
| 120 |
| 12g |
解得:x=0.2g,y=9.8g
所以消耗30%的稀硫酸的质量为:9.8g÷30%=32.7g
故答案为:0.2;32.7.

练习册系列答案
相关题目
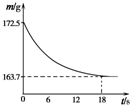 称取某纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示.
称取某纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示.