题目内容
【题目】【实验一】结合下列实验装置图回答问题
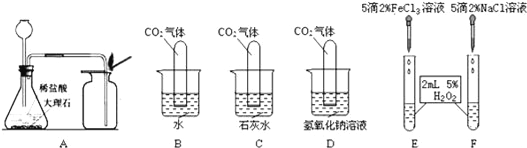
(1)用A图制取二氧化碳气体,反应的化学方程式为:________________,若锥形瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭,则是由于A装置存在缺陷,其缺陷为______;
(2)图B、C、D是探究二氧化碳化学性质的实验,C中发生反应的化学方程式是_________________,证明二氧化碳与氢氧化钠溶液发生反应的现象是______;
(3)图E和F是探究哪种离子能促进H2O2分解的实验,现象是:E中产生大量气泡,F中没有明显现象,则促进H2O2分解的离子符号是_______.
【实验二】探究燃烧的条件
实验:下图的装置可用于探究燃烧的条件
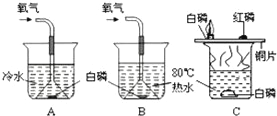
现象:①不通氧气时,A中白磷不燃烧;②不通氧气时,B中白磷不燃烧;③通氧气时,A中白磷不燃烧;④通氧气时,B中白磷燃烧
(1)证明可燃物燃烧,温度必须达到着火点的现象是______(填序号);
(2)A、B组合与C装置相比的优点是______.
【答案】 CaCO3+2HCl═CaCl2+H2O+CO2↑ 长颈漏斗未伸入液面,造成气体逸出 CO2+Ca(OH)2=CaCO3↓+H2O Fe3+ 试管中的液面上升 ③④ C装置在密闭环境中进行,避免了P2O5对空气的污染
【解析】实验一(1)根据反应物是石灰石和盐酸,生成物是氯化钙、水和二氧化碳,反应方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;装置的气密性都是经过检验的,观察装置看到长颈漏斗下端的管口与大气是相通的,生成的二氧化碳会从管口逸到空气中装置的气密性都是经过检验的,观察装置看到长颈漏斗下端的管口与大气是相通的,生成的二氧化碳会从管口逸到空气中,A装置存在缺陷为长颈漏斗未伸入液面,造成气体逸出;(2)C中发生反应的化学方程式是:CO2+Ca(OH)2=CaCO3↓+H2O;(3)根据现象:E中产生大量气泡,F中没有明显现象分析,氯离子、钠离子不能使过氧化氢分解速度加快,所以是铁离子使双氧水分解的速率加快;实验二(1)能证明可燃物必须达到一定温度(着火点)的变量是:温度,有冷水,有热水,有热水的必须能够燃烧,其它变量均相同,所以③④符合这一说法
(2)C装置在密闭环境中进行,避免了P2O5对空气的污染。

 阅读快车系列答案
阅读快车系列答案【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 20 | 17.4 |
第2次 | 20 | 14.8 |
第3次 | 20 | 12.2 |
第4次 | 20 | 12.0 |
第5次 | 20 | m |
试回答下列问题:
(1)上述表格中m的值为_____________;
(2)黄铜样品中锌的质量分数为_________;
(3)所用稀硫酸中溶质的质量分数是__________?
【题目】海洋中蕴藏着丰富的化学资源,如NaCl、MgCl2、CaCl2等物质。从海水中提取金属镁的主要流程如下:

(1)电解熔融的无水MgCl2可以得到金属镁。该反应属于基本反应类型中的 反应。
(2)将海水中的镁提取出来,首先要让海水中的镁离子形成沉淀而富集起来。结合表中数据分析,为了使氯化镁转化为沉淀,应加入溶液A可能是 。
室温下几种物质的溶解度
物质 | MgCO3 | CaCO3 | Mg(OH)2 | Ca(OH)2 |
溶解度/g | 0.01 | 0.0013 | 0.0029 | 0.16 |

(3)结合MgCl2的溶解度曲线分析,操作I:蒸发浓缩、 、过滤。