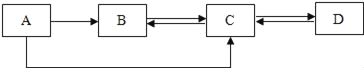
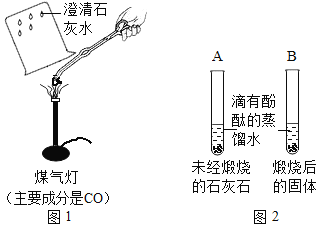
题目内容
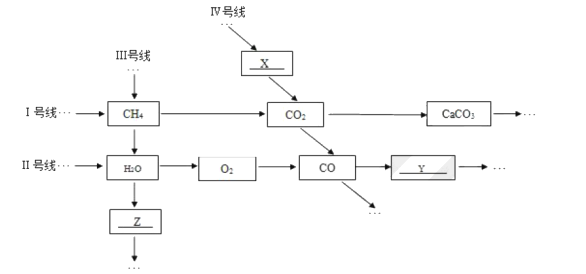
【题目】我国煤炭资源丰富。目前人们除了将煤作为燃料外,更关注煤化工技术。工业上以煤和空气为原料生产尿素[CO(NH2)2]的一种流程如下:
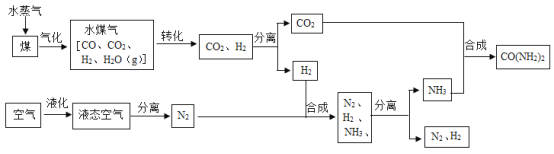
(1)从液态空气中分离出N2的过程属于_____(填“物理”或“化学”)变化。
(2)在煤和水蒸气反应前需先将煤粉碎,这样做的目的是______。
(3)水煤气在铜催化下实现CO的转化:CO+H2O![]() CO2+X,其中X的化学式为____。
CO2+X,其中X的化学式为____。
(4)上述流程中,在一定条件下合成尿素的同时还有水生成,该反应的化学方程式为____。
(5)实际生产中,反应不可能完全进行。上述流程中可以循环利用的物质有______。
(6)合成的尿素[CO(NH2)2]是重要的化学肥料,区分尿素与硫酸铵[ (NH4)2 SO4]可进行以下操作:分别取样于试管中,加入氢氧化钠溶液并加热,在试管口放一张湿润的______色石蕊试纸,观察颜色变化。
【答案】物理 增大反应物接触面积,使反应更快、更充分 H2 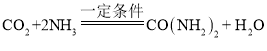 N2、H2 红
N2、H2 红
【解析】
(1)从液态空气中分离出N2,是利用空气中各物质沸点的不同,将其分离,无新物质生成,属于物理变化;
(2)将煤粉碎,可以增大反应物的接触面积,使反应更充分,提高反应速率,故填:增大反应物接触面积,使反应更快、更充分;
(3)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中,碳原子数目为1,氢原子数目为2,氧原子数目为2,生成物中碳原子数目为1,氧原子数目为2,故生成物中氢原子数目应为2,故X的化学式为:H2;
(4)由图可知,氨气和二氧化碳在一定条件下反应生成尿素和水,该反应的化学方程式为: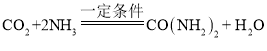 ;
;
(5) 由图可知,氮气和氢气既是生成物,又是反应物,可以循环利用,故填:N2、H2;
(6)硫酸铵属于铵态氮肥,铵态氮肥能与氢氧化钠在加热的条件下反应生成氨气,尿素不属于铵态氮肥,与氢氧化钠不反应,故区分尿素和硫酸铵,只需验证加入氢氧化钠溶液并加热,是否有氨气生成,氨气溶于水形成氨水,氨水呈碱性,检验碱性物质,应用红色石蕊试纸,红色石蕊试纸变蓝,说明是硫酸铵,红色石蕊试纸不变色,说明是尿素,故填:红。

【题目】利用下图所示装置可以进行实验室制备气体。
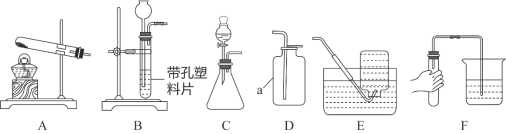
(1)实验室用KMnO4制备O2的化学方程式是______________________________。
(2)选择发生和收集O2的装置,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
H2O2溶液、MnO2 | ______ | 收集较纯净O2_______ |
KClO3、MnO2 | ______ | 收集较干燥O2______ |
(3)实验室用上述装置C制取CO2时,该反应生成二氧化碳中常混有少量氯化氢气体,某同学想通过图一装置探究是否有HCl气体,在广口瓶中盛放的试剂是硝酸银溶液,你认为混合气体应从__________(填“a”或“b”)进入。
![]()
(4)制取气体前应先检查的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是__________(选填编号)。
A.将烧杯换成水槽 B.将导管伸入水中位置过深,气体无法逸出
C.试管口橡皮塞未塞紧 D.先用手捂住试管,再将导管另一端插入水中