题目内容
【题目】铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g于烧杯中,然后等量分5次加入未知质量分数的某强酸(W)溶液,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
项目 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入W溶液的质量/g | 5 | 5 | 5 | 5 | 5 |
每次产生气体的质量/g | 0.01 | 0.01 | 0.01 | 0.005 | 0 |
(1)写出你所选择酸(W)的化学式 。
(2)铜粉中混有铁粉的质量是 。
(3)计算你选择酸(W)的质量分数(写出计算过程)。
【答案】(1)H2SO4(或HCl)(2)0.98g(3)9.8%或7.3%(详见解析)
【解析】
解:(1)铁的金属活动性排在氢的前面,会置换出硫酸或盐酸中的氢,所以所选择酸(W)的化学式是:H2SO4(或HCl);
(2)根据图表信息,共生成氢气的质量为:0.01g+ 0.01g+0.01g+0.005g =0.035g
设参加反应的铁的质量为![]() ,
,
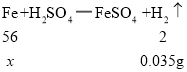
![]()
![]() =0.98g
=0.98g
(3)①假设该酸是硫酸,设5g该硫酸溶液中含H2SO4的质量为![]() ,
,
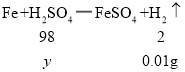
![]()
![]() =0.49g
=0.49g
该硫酸溶液中溶质的质量分数为![]() ×100%=9.8%;
×100%=9.8%;
答:该硫酸溶液中溶质的质量分数为9.8%。
②假设该酸是盐酸,设5g该盐酸溶液中含HCl的质量为![]() ,
,
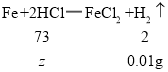
![]()
![]() =0.365g
=0.365g
该盐酸溶液中溶质的质量分数为![]() ×100%=7.3%。
×100%=7.3%。
答:若选择的酸为硫酸,该硫酸溶液中溶质的质量分数为9.8%;
若选择的酸为盐酸,则质量分数为7.3%。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】有一包固体物质,可能含有硫酸钠、碳酸钙、氯化钾、碳酸钠、硫酸铜和氢氧化钠中的一种或几种。为探究其组成,进行如下实验。
(1)取少量固体按以下流程实验

根据步骤①可知固体中一定不含有_______________(填化学式)。
(2)向白色沉淀B中滴加过量稀盐酸,发现仍有部分固体剩余;则固体物质中的成分中一定有的是________(填化学式)。
(3)为进一步确定固体中可能含有的物质,兴趣小组进行如下探究:
[猜想与假设]
猜想一:氯化钾
猜想二:氢氧化钠
猜想三:_________________
实验操作 | 实验现象 | 结论与评价 |
1. 取少量溶液C于试管,滴加无色酚酞试液 | __________ | 猜想一不成立 |
2.另取少量溶液C于试管,滴加过量稀硝酸后,再滴加___________溶液 | __________ | 猜想三成立 |
[反思交流]工业流程步骤②中不能将Ba(NO3)2溶液换成Ba(OH)2溶液的原因是:__________________。
【题目】为了测定实验中氯酸钾样品的纯度,某兴趣小组取2.5克样品与0.8克二氧化锰混合。加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以下操作,依次称得加热t1、t2、 t3、t4时间后剩余固体的质量,记录数据如表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.41 | 2.34 | 2.34 |
请仔细分析实验数据,回答下列问题:
(1)在多长时间后,该样品中的氯酸钾已经反应完全。
(2)计算完全反应后生成氧气的质量为多少。
(3)求该样品中氯酸钾的质量分数。