题目内容
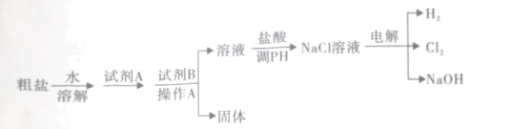
【题目】有一包固体物质,可能含有硫酸钠、碳酸钙、氯化钾、碳酸钠、硫酸铜和氢氧化钠中的一种或几种。为探究其组成,进行如下实验。
(1)取少量固体按以下流程实验

根据步骤①可知固体中一定不含有_______________(填化学式)。
(2)向白色沉淀B中滴加过量稀盐酸,发现仍有部分固体剩余;则固体物质中的成分中一定有的是________(填化学式)。
(3)为进一步确定固体中可能含有的物质,兴趣小组进行如下探究:
[猜想与假设]
猜想一:氯化钾
猜想二:氢氧化钠
猜想三:_________________
实验操作 | 实验现象 | 结论与评价 |
1. 取少量溶液C于试管,滴加无色酚酞试液 | __________ | 猜想一不成立 |
2.另取少量溶液C于试管,滴加过量稀硝酸后,再滴加___________溶液 | __________ | 猜想三成立 |
[反思交流]工业流程步骤②中不能将Ba(NO3)2溶液换成Ba(OH)2溶液的原因是:__________________。
【答案】CaCO3 、CuSO4 Na2CO3 、Na2SO4 KCl、NaOH(氯化钾、氢氧化钠) 无色酚酞变红 AgNO3(硝酸银)溶液 有白色沉淀产生 若换成氢氧化钡则无法判定氢氧化钠的存在;(合理即可)
【解析】
(1)根据步骤①可知,得到无色溶液,因为碳酸钙不溶于水,硫酸铜溶于水显蓝色,所以说明固体中不含有硫酸铜和碳酸钙。
(2)向白色沉淀B中滴加过量稀盐酸,发现仍有部分固体剩余,说明白色沉淀是硫酸钡和碳酸钡的混合物,则固体物质中的成分中一定有的是Na2SO4、Na2CO3。
(3)[猜想与假设]
由以上分析可知,可能含有的物质是氯化钾和氢氧化钠。故
猜想一:氯化钾
猜想二:氢氧化钠
猜想三:氯化钾和氢氧化钠;
实验过程如下所示:
1.取少量溶液C于试管,滴加无色酚酞试液,溶液变红色,说明溶液中含有氢氧化钠,猜想一不成立;
2.另取少量溶液C于试管,滴加过量稀硝酸后,再滴加硝酸银溶液,产生白色沉淀,是因为氯化钾和硝酸银反应生成白色沉淀氯化银和硝酸钾,猜想三成立。
[反思交流]
工业流程步骤②中不能将Ba(NO3)2溶液换成Ba(OH)2溶液的原因是氢氧化钡和硫酸钠、碳酸钠反应能够生成氢氧化钠,影响对氢氧化钠的检验。

 王后雄学案教材完全解读系列答案
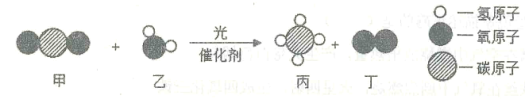
王后雄学案教材完全解读系列答案【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质
【题目】铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g于烧杯中,然后等量分5次加入未知质量分数的某强酸(W)溶液,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
项目 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入W溶液的质量/g | 5 | 5 | 5 | 5 | 5 |
每次产生气体的质量/g | 0.01 | 0.01 | 0.01 | 0.005 | 0 |
(1)写出你所选择酸(W)的化学式 。
(2)铜粉中混有铁粉的质量是 。
(3)计算你选择酸(W)的质量分数(写出计算过程)。