题目内容
【题目】绿矾(FeSO47H2O)是硫酸法生产太白粉的主要副产物,可用于制备 Fe2O3、复印用 Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作,某研究小组研究制备 Fe2O3。
(查阅资料)
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO47H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有刺激性气味的有毒气体,能使品红溶液褪色;SO2在0℃时是一种无色晶体。
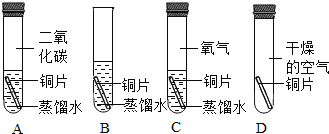
甲同学用如下装置制备 Fe2O3并验证绿矾受热分解的其他产物:
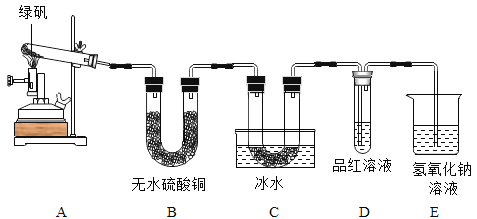
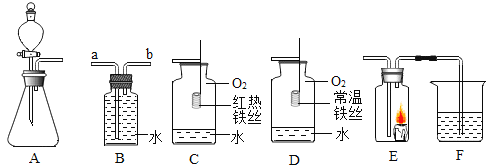
A B C D E
实验过程中发现:A 中有________色固体生成,B 中无水硫酸铜变蓝,C 中 U 形管内有无色晶体(SO3)析出,D 中品红溶液褪色,装置 E 的作用是_______,绿矾高温分解的化学方程式为____。
(反思与拓展)乙同学认为此实验装置有发生倒吸的可能,你认为乙同学的担心有无道理?______。(填“有”或“无”)
【答案】红棕色 吸收二氧化硫,防止污染空气  ; 有
; 有
【解析】
(1)由题干可知:绿矾(FeSO47H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物,故A装置中生成Fe2O3,Fe2O3是红棕色固体,故填:红棕色;
B 中无水硫酸铜变蓝,说明绿矾分解有水生成,无水硫酸铜遇水变蓝;
SO2是无色有刺激性气味的有毒气体,氢氧化钠可以吸收二氧化硫,故填:吸收二氧化硫,防止污染空气;
C中U型管内有无色晶体析出,说明绿矾分解生成三氧化硫;
由题可知:绿矾高温分解的产物为:氧化铁、二氧化硫、三氧化硫、水,故方程式为: ;
;
(2)E装置中二氧化硫与氢氧化钠反应较快,导致左边装置内压强变小,容易发生倒吸,故填:有。

【题目】学习化学可以了解原理,便于解决问题.
(1)一小组的同学利用干冰做兴趣实验(如图).在降温加压时二氧化碳会变成无色液体,温度进一步降低,液态二氧化碳可变成雪花状固体—干冰.上述过程发生了____(填“物理”或“化学”)变化,说明分子具有的性质是___.

(2)如图是燃气热水器示意图,该热水器以天然气为燃气.
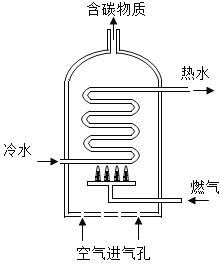
①当“空气进气孔”被部分堵塞,燃烧将产生的有毒气体M,M的化学式为____;
②1kg不同燃料燃烧产生CO2和SO2的质量如表所示.其中较清洁的燃料是____,使用___作燃料时最易形成酸雨
燃料 | 燃烧产物质量/g | |
CO2 | SO2 | |
汽油 | 2900 | 5.0 |
天然气 | 2500 | 0.1 |
煤 | 2500 | 11.0 |
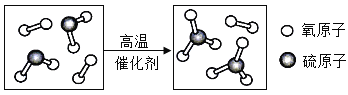
(3)酸雨形成过程中某一步反应的微观示意图如图所示.则该反应的化学方程式为____,反应中“![]() ”和“
”和“![]() ”的质量比为_____.
”的质量比为_____.