题目内容
【题目】某学生为了鉴别稀H2SO4、Na2CO3溶液、NaOH溶液、盐酸四种无色溶液,分别取少许放入试管,编号为A、B、C、D,进行实验。
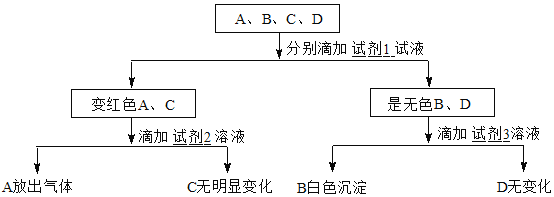
(1)请你填写有关试剂名称或化学式。试剂1_____试剂2_____试剂3_____。
(2)写出滴加试剂3后鉴别出B物质所发生反应的化学方程式:_____。
【答案】酚酞 盐酸(或硝酸、硫酸) 氯化钡(或硝酸钡) BaCl2+H2SO4═BaSO4↓+2HCl或H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
【解析】
稀H2SO4、Na2CO3溶液、NaOH溶液、盐酸四种无色溶液中,Na2CO3溶液、NaOH溶液显碱性,稀H2SO4、盐酸显酸性;滴加试剂1后A、C变红,B、D无色,可判断试剂1为酚酞,A、C为碱性溶液,B、D为酸性溶液;Na2CO3溶液、NaOH溶液中Na2CO3可以与强酸反应产生气泡。稀H2SO4、盐酸中H2SO4可以与氯化钡(或硝酸钡)反应产生白色沉淀;故可推知试剂2为盐酸(或硝酸、硫酸),试剂3为氯化钡(或硝酸钡),滴加试剂3后鉴别出B物质所发生反应的化学方程式为:BaCl2+H2SO4═BaSO4↓+2HCl或H2SO4+Ba(NO3)2=BaSO4↓+2HNO3。
故答案是:(1)酚酞;盐酸(或硝酸、硫酸);氯化钡(或硝酸钡);
(2)BaCl2+H2SO4═BaSO4↓+2HCl或H2SO4+Ba(NO3)2=BaSO4↓+2HNO3。

【题目】实验室常用如图装置测定空气中氧气的含量。
(实验原理)该实验反应的原理是_____(用化学方程式表示)。
(实验步骤)具体实验步骤有:
①在硬质玻璃管中装入铜粉,两端塞上带导管的橡皮塞,其中一端用气球密封;
②测量出实验所用硬质玻璃管的体积;
③停止加热后,待试管冷却至室温,注射器活塞稳定后,记录注射器中气体的体积;

④用酒精灯在铜粉部位加热,加热时不断推拉注射器:
⑤移动注射器活塞,在注射器中留下一定体积的气体,记录体积后与硬质玻璃管另一端密封连接,并将硬质玻璃管固定在铁架台上。
(1)正确的操作步骤为_____(填数字序号);
(2)在实验加热过程中,硬质玻璃管中观察到的现象是_____;缓慢推拉注射器活塞的目的是_____。
(实验记录)下表是某小组同学记录的实验数据,填写上表中空白。
硬质玻璃管的容积/mL | 反应前注射器中气体体积/mL | 反应后注射器中气体体积/mL | 反应消耗的氧气体积/mL | 空气中氧气的体积分数 |
50 | 20 | 6 | _____ | _____ |
(实验分析)从上述数据中可知,该实验存在一定误差,导致该误差的原因可能是_____。(写一条即可)