题目内容
【题目】A、B、C 三种物质的溶解度曲线如图所示。
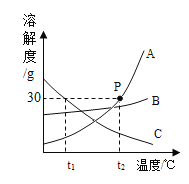
(1)P 点表示 t2℃时完全溶解30gA 物质至少需_______________g水。
(2)现有 A、B、C 三种物质的浓溶液,适用于海水晒盐原理进行结晶的是_______________。(填序号)
(3)将 t1℃时 A、B、C 三种物质的饱和溶液分别升温至t2℃时,所得溶液的溶质质量分数由大到小的顺序是__________________。
(4)向 100g t2℃的水中加入 33g A 固体,发现全部溶解,一段时间后又有部分A的晶体析出。你认为“全部溶解”的原因可能是____________________。
【答案】100 B B>C>A A物质溶解时放热
【解析】
(1)P点在溶解度曲线上,指的是该温度下100g水中最多溶解 30gA,故填:100;
(2)海水晒盐原理为蒸发结晶,适用于溶解度随温度变化不大的物质,故选B;
(3)升温后,C有晶体析出形成t2℃下的饱和溶液,A、B由于溶解度增大形成不饱和溶液,溶质质量分数维持t1℃不变,t1℃ A的溶解度大于t2℃ C的溶解度,大于t1℃A的溶解度,根据饱和溶液的溶质质量分数=![]() ,可知升温后溶质质量分数B>C>A;故填:B>C>A;
,可知升温后溶质质量分数B>C>A;故填:B>C>A;
(4)t2℃时100g的水中最多溶解30gA物质,且A物质溶解度随温度升高而升高,因此“全部溶解”的原因可能是A物质溶解时放热,故填:A物质溶解时放热。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】碱石灰是CaO与NaOH的固体混合物,通常用于吸收CO2及干操气体。某学校实验小组在实验室取了一定量已经使用过的碱石灰样品,并对其成分进行了如下探究。
[提出猜想]该碱石灰样品中可能含有CaO、___________ (填化学式)、CaCO3、NaOH和Na2CO3.
[设计方案] (1)甲同学在烧怀中放入适量的该碱石灰样品,先加入少量水,未发现放热现象,再加入足量蒸馏水充分搅拌,静置,有白色沉淀出现,甲同学认为样品中一定含有CaCO3.你认为甲同学的结论是否严谨?理由是:______________________________。
(2)乙同学进一步设计实验并进行验证,过程如下表:
实验操作 | 实验现象 | 实验结论 |
① 从甲同学的烧杯中取少量上层清液 于试管中,向其中滴加足量________溶液。 | 有白色沉淀生成 | 样品中一定有Na2CO3 |
② 将操作①所得到的混合物,过滤,向滤液中滴加无色酚酞试液。 | 无明显现象 | 滤液中不含有NaOH |
[实验结论]你认为通过以上甲、乙两位同学的实验探究,是否可以确定该碱石灰样品的组成成分?若能,请写出其组成;若不能,请说明理由______________________________。
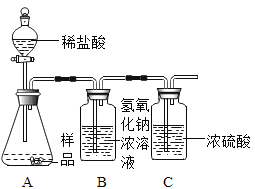
[实验反思]丙同学进一步设计了如图所示的实验装置,通过称量B装置的质量变化来测定一定量样 品与足量稀盐酸反应所生成的CO2的质量(气密性良好,每步均完全反应,操作无误)。若丙同学最终测得的CO2质量比实际值小,你认为可能原因是____________________。