题目内容
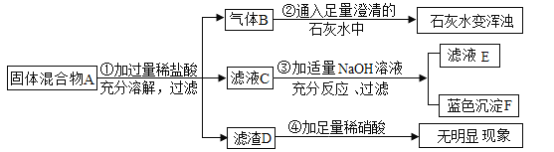
【题目】以300g30.4%的FeSO4溶液为原料制铁黑画料Fe3O4(其中Fe既有+2价,也有+3价)的过程如下:
![]()
已知:FeSO4+2NaOH=Fe(OH)2 ↓+Na2SO4;4Fe(OH)2+O2+H2O=4Fe(OH)3
下列说法中,正确的是
A.制备的过程中只有Fe的化合价发生变化
B.洗涤的目的仅仅是为了除去生成的Na2SO4
C.理论上Fe(OH)2转化为Fe(OH)3的过程中参与反应的O2的质量为3.2g
D.该方法理论上最终可以获得Fe3O4的质量为46.4g
【答案】D
【解析】
依题目可知,FeSO4溶液主要通过三个化学反应制得铁黑画料Fe3O4,根据这三个反应过程分析,选择正确说法。
A、制备的过程中Fe的化合价和氧气中氧元素的化合价都发生变化,不符合题意;
B、洗涤的目的为了除去生成的Na2SO4和过量的氢氧化钠,不符合题意;
C、设理论上Fe(OH)2转化为Fe(OH)3的过程中参与反应的O2的质量为X。
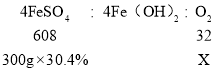
![]()
![]()
所以,理论上Fe(OH)2转化为Fe(OH)3的过程中参与反应的O2的质量为4.8g,不符合题意;
D、设该方法理论上最终可以获得Fe3O4的质量为X。
根据质量守恒定律,反应前后铁元素的质量不变,所以FeSO4和Fe3O4中含的铁元素的质量相等。
![]()
![]()
该方法理论上最终可以获得Fe3O4的质量为46.4g,符合题意。故选D。

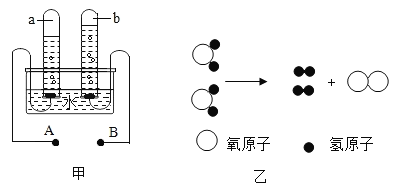
【题目】某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
(提出问题)是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
(猜想与假设)他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
(设计实验)三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 设计这一步骤目的 | 实验现象 | 实验结论 |
1.将NaOH溶液加热煮沸 | _____ | 溶液变红,过一会儿红色消失 | 甲同学猜想_____(填“正确”或不正确”) |
2.向冷却后的溶液中滴入酚酞,并滴一些植物油在其上方 | _____ |
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。

请写出CO2与NaOH溶液反应的化学方程式:_____。甲同学认为乙同学的实验不够严谨,理由是_____。