题目内容
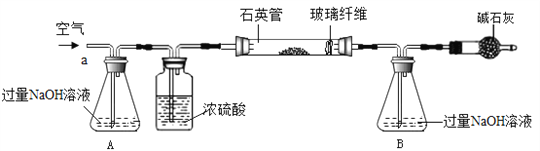
【题目】大海是取之不尽的化工原料宝库,从海水中可提取各项化工原料,下图是工业对海水进行几项综合利用的示意图,根据图示填空:
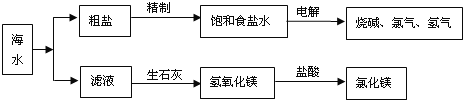
(1)在滤液(含氯化镁)中加入生石灰制取氢氧化镁时所发生反应的化学方程式:____________________、_______________________。
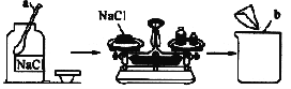
(2)某课外化学活动小组取海水,蒸发、结晶,然后过滤,得到粗盐,过滤时,必须用到的玻璃仪器有________________________。
(3)若粗盐中尚存在CaCl2等杂质,为了除去CaCl2,可在“精制饱和食盐水”时加入过量的________(写化学式)溶液,再过滤,并加入适量的________(填试剂名称)即可;如果井水或溪水中含有的Ca2+、Mg2+较多,这种水称作________,日常生活中降低水中Ca2+、Mg2+的方法是________。
【答案】 CaO+H2O=Ca(OH)2 Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 漏斗、烧杯、玻璃棒 Na2CO3 稀盐酸 硬水 煮沸
【解析】(1)氧化钙能与滤液中的水反应生成氢氧化钙,CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 (2)过滤时用到的玻璃仪器有漏斗、烧杯、玻璃棒。(3)除去杂质的原则是加入的试剂把杂质反应掉,且不生成新的杂质,故加入的试剂是Na2CO3,
Na2CO3 + CaCl2 == CaCO3↓+ 2NaCl,因为实验过程中加入过量的Na2CO3,故滤液中有Na2CO3剩余,最后要加入稀盐酸将Na2CO3除去,Na2CO3+2HCl==2NaCl+H2O+CO2↑。含有较多Ca2+、Mg2+的水叫做硬水,日常生活中常用煮沸的方法降低水的硬度。

 名校课堂系列答案
名校课堂系列答案