题目内容
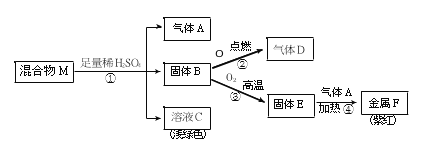
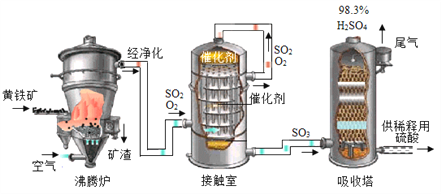
【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。现以黄铁矿为原料生产硫酸,工艺流程如图所示
(查阅资料)![]()
(1) 接触室中发生反应的化学方程式为________________。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是________g,稀释时,应将______沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,请写出稀硫酸的一种用途____________。
(2) 依据生产硫酸的工艺流程图,下列说法正确的是_____________(填字母).
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.SO2可作为生产硫酸的原料再利用 D.沸腾炉排出的矿渣可供炼铁.
(3) 化学兴趣活动小组称取1.6g黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,最终B锥形瓶中增重1.28g.
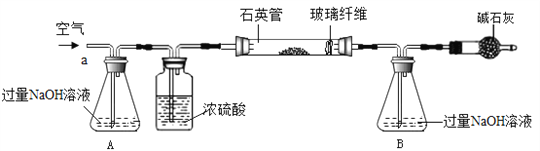
①A中NaOH溶液的作用____________________________。
②计算该黄铁矿中FeS2的质量分数___________。(假设每步反应均完全)
【答案】 2SO2+O2![]() 2SO3 880 浓硫酸 除铁锈、精炼石油等 ACD 除去进入装置内空气中的CO2 75%
2SO3 880 浓硫酸 除铁锈、精炼石油等 ACD 除去进入装置内空气中的CO2 75%
【解析】根据所学知识和题中信息知,(1) 接触室中发生反应的化学方程式为2SO2+O2![]() 2SO3。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是∶100g×98%=10%×﹙100g+x﹚,x=880g。稀释时,应将浓硫酸沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,稀硫酸的一种用途是除铁锈、精炼石油等。(2)由题中信息知,A、为使黄铁矿充分燃烧,需将其粉碎,增大反应的接触面积,故A正确;B、催化剂能够提高SO2的反应速率,但不会提高产量,故B错误;C、SO2可作为生产硫酸的原料再利用,既环保,又节约了资源,故C正确;D、沸腾炉排出的矿渣可供炼铁,矿渣中含有铁元素,故D正确。(3) ①A中NaOH溶液的作用是除去进入装置内空气中的CO2,CO2与NaOH溶液反应生成碳酸钠。②根据质量守恒定律知生成二氧化硫质量是1.28g。解∶设黄铁矿中FeS2的质量分数为x
2SO3。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是∶100g×98%=10%×﹙100g+x﹚,x=880g。稀释时,应将浓硫酸沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,稀硫酸的一种用途是除铁锈、精炼石油等。(2)由题中信息知,A、为使黄铁矿充分燃烧,需将其粉碎,增大反应的接触面积,故A正确;B、催化剂能够提高SO2的反应速率,但不会提高产量,故B错误;C、SO2可作为生产硫酸的原料再利用,既环保,又节约了资源,故C正确;D、沸腾炉排出的矿渣可供炼铁,矿渣中含有铁元素,故D正确。(3) ①A中NaOH溶液的作用是除去进入装置内空气中的CO2,CO2与NaOH溶液反应生成碳酸钠。②根据质量守恒定律知生成二氧化硫质量是1.28g。解∶设黄铁矿中FeS2的质量分数为x
4FeS2 +11O2 ![]() 2Fe2O3 +8SO2
2Fe2O3 +8SO2
480 512
1.6g×x 1.28g
![]() =
=![]() ,x=75%。
,x=75%。
答∶①A中NaOH溶液的作用是除去进入装置内空气中的CO2。②该黄铁矿中FeS2的质量分数是75%。
点睛∶浓硫酸密度比水大,稀释,放热,一定要把浓硫酸倒入水中。硫酸是一种重要的化工产,用途十分广泛,稀硫酸的一种用途是除铁锈、精炼石油等。