题目内容
【题目】下列实验方案能达到实验目的是
选项 | A | B | C | D |
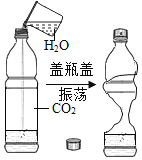
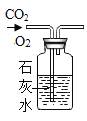
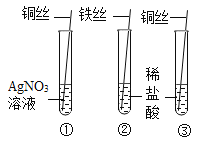
实验 目的 | 证明CO2可与H2O反应生成H2CO3 | 除去O2中混有的CO2 | 证明某混合溶液中含有碳酸盐 | 验证铁、铜、银三种金属的活动性顺序 |
实验方案 |
|
|
|
|
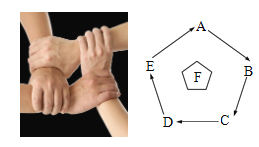
A.AB.BC.CD.D
【答案】D
【解析】
A、二氧化碳能溶于水,使瓶内压强减小,使塑料瓶变瘪,故塑料瓶变瘪不能证明二氧化碳与水反应生成了碳酸,不符合题意;
B、除去O2中混有的CO2,一般用氢氧化钠溶液,而不用氢氧化钙,因为氢氧化钙微溶于水,可能不能完全吸收二氧化碳,通常用氢氧化钙溶液检验二氧化碳,不符合题意;
C、向混合溶液中滴加稀盐酸,有气泡产生,该混合溶液中不一定含碳酸盐、还可能是碳酸氢盐,亚硫酸盐等,不符合题意;
D、铜能与硝酸银反应生成硝酸铜和银,有银白色固体析出,说明在金属活动性顺序里,铜位于银之前,铁能与稀盐酸反应生成氯化亚铁和氢气,有气泡产生,铜不与稀盐酸反应,无明显现象,说明在金属活动性顺序里,铁位于氢之前,铜位于氢之后,可以验证铁、铜、银三种金属的活动性顺序,符合题意。
故选D。

 寒假天地重庆出版社系列答案
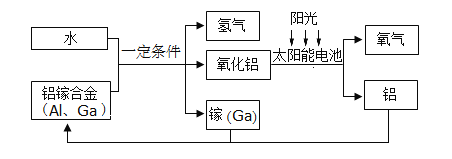
寒假天地重庆出版社系列答案【题目】为了探究碳与氧化铜反应的气体产物中是否有一氧化碳,某同学进行如下实验过程。(装置B和D内均是足量澄清石灰水)

①A处加热一段时间后,试管中的现象是_______。
②B处石灰水变浑浊,其反应的化学方程式是______,
③若能说明A处反应的气体产物中有一氧化碳,依据的一个现象是_____。
为进一步确定碳与氧化铜反应产生一氧化碳的质量,该同学测量了如下数据:
A处 试管内物质 | B处 瓶内物质 | C处 玻璃管内物质 | D处 瓶内物质 | |
反应前后质量变化量 (g) | a | b | c | d |
则一氧化碳的质量m(CO)=____________。(用上述字母表达)
④停止实验,待C处玻璃管冷却,倒出固体于试管中,加入足量稀硫酸,看到____现象,则推出固体的成分是氧化铜和铜。
【题目】Ca(OH)2 和NaOH是重要的碱。在不同温度时的溶解度如下:
温度(°C) | 20 | 40 | 60 | 80 | |
溶解度(g/100g 水) | Ca(OH)2 | 0.17 | 0.14 | 0.09 | 0.08 |
NaOH | 109 | 129 | 174 | 314 | |
①20°C时Ca(OH)2的溶解度是_________。
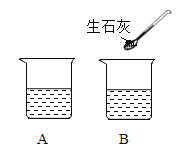
②A、B二只烧杯装有等质量的饱和石灰水(如图所示)。B烧杯中加入少量生石灰,写出发生反应的化学方程式___________。此时,A、B烧杯中溶液质量A__________B (选填“>”、“<”或“=”)。
③20°C时100g饱和NaOH溶液蒸发10g水后,恢复到原温度,析出___________gNaOH固体。
④60°C时NaOH饱和溶液中含少量Ca(OH)2,若要得到较纯净NaOH晶体,应采取的物理方法是________。
⑤若在20°C时,鉴别Ca(OH)2、NaOH饱和溶液,可选用的方法是_____________。
I 降低温度
II 滴加酚酞溶液
III 测pH
IV 滴入盐酸