题目内容
【题目】Ca(OH)2 和NaOH是重要的碱。在不同温度时的溶解度如下:
温度(°C) | 20 | 40 | 60 | 80 | |
溶解度(g/100g 水) | Ca(OH)2 | 0.17 | 0.14 | 0.09 | 0.08 |
NaOH | 109 | 129 | 174 | 314 | |
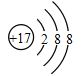
①20°C时Ca(OH)2的溶解度是_________。
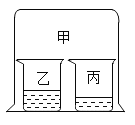
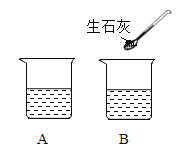
②A、B二只烧杯装有等质量的饱和石灰水(如图所示)。B烧杯中加入少量生石灰,写出发生反应的化学方程式___________。此时,A、B烧杯中溶液质量A__________B (选填“>”、“<”或“=”)。
③20°C时100g饱和NaOH溶液蒸发10g水后,恢复到原温度,析出___________gNaOH固体。
④60°C时NaOH饱和溶液中含少量Ca(OH)2,若要得到较纯净NaOH晶体,应采取的物理方法是________。
⑤若在20°C时,鉴别Ca(OH)2、NaOH饱和溶液,可选用的方法是_____________。
I 降低温度
II 滴加酚酞溶液
III 测pH
IV 滴入盐酸
【答案】0.17g/100g水 ![]() > 10.9 降温结晶 I III
> 10.9 降温结晶 I III
【解析】
①由表中数据可知,20°C时Ca(OH)2的溶解度是0.17g/100g水;
②氧化钙和水反应生成氢氧化钙,反应的化学方程式![]() ;导致B烧杯中的水减少,且氧化钙与水反应放出热量,使烧杯内温度升高,氢氧化钙的溶解度随温度的升高而减小,故氢氧化钙析出一部分,所以A、B烧杯中溶液质量A>B;
;导致B烧杯中的水减少,且氧化钙与水反应放出热量,使烧杯内温度升高,氢氧化钙的溶解度随温度的升高而减小,故氢氧化钙析出一部分,所以A、B烧杯中溶液质量A>B;
③20℃时,100g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH晶体的质量为x,![]() ,x=10.9g;
,x=10.9g;
④现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶,因为氢氧化钠的溶解度随温度的升高而增加,且受温度的影响变化比较大,氢氧化钙的溶解度随温度的升高而减小;
⑤I、根据表中数据可知,氢氧化钠的溶解度随温度升高而增大,氢氧化钙的溶解度随温度升高而减小,将20°C时,Ca(OH)2、NaOH饱和溶液降温后,有晶体析出的是氢氧化钠,没有晶体析出的是氢氧化钙,故正确;
II、Ca(OH)2、NaOH溶液都能使酚酞溶液变红,无法鉴别,故错误;
III、根据表中数据可知,20°C时,NaOH的溶解度比Ca(OH)2的溶解度大,故饱和NaOH溶液比饱和Ca(OH)2溶液浓度大,碱性强,所以通过测pH可以鉴别,故正确;
IV、盐酸和Ca(OH)2、NaOH溶液反应后都没有明显现象,无法鉴别,故错误。故选I、III。

【题目】下列实验方案能达到实验目的是
选项 | A | B | C | D |
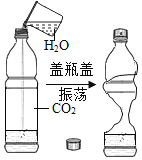
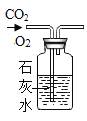
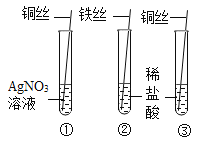
实验 目的 | 证明CO2可与H2O反应生成H2CO3 | 除去O2中混有的CO2 | 证明某混合溶液中含有碳酸盐 | 验证铁、铜、银三种金属的活动性顺序 |
实验方案 |
|
|
|
|
A.AB.BC.CD.D