题目内容
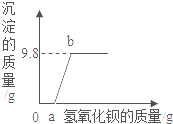
【题目】某溶液中可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,取一定质量的该溶液,向其中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。请回答下列问题。
(1)该溶液中一定含有的溶质是_____,可能含有的溶质是_____。(均填化学式)
(2)请写出上述过程中发生中和反应的化学方程式_____。
(3)当滴加氢氧化钡溶液至图中b点时,溶液中一定含有的溶质是_____。(填化学式)
(4)所取溶液中含有氯化铜的质量为_____。
【答案】HCl、CuCl2 NaNO32HCl+Ba(OH)2═BaCl2+2H2OBaCl213.5g
【解析】
由题目的信息和像可知:氯化铜与氢氧化钡能产生氢氧化铜蓝色沉淀,硫酸与氢氧化钡反应生成硫酸钡白色沉淀,沉淀开始时没有产生,说明原溶液中有酸。硫酸钡不溶于三大强酸,因此有盐酸,没有硫酸;氯化铜与氢氧化钡能产生氢氧化铜蓝色沉淀,并且符合题意,因此一定有氯化铜,而硝酸钠不能确定,据此解答。
上述分析可知
根据
(1)根据上述分析可知:该溶液中一定含有的溶质是盐酸和氯化铜,化学式分别为HCl、CuCl2;可能含有的溶质是硝酸钠,化学式为NaNO3;
(2)盐酸和氢氧化钡反应生成氯化钡和水,该反应是酸与碱作用生成盐和水的反应,属于中和反应,反应的化学方程式是2HCl+Ba(OH)2═BaCl2+2H2O;
(3)到达b点,盐酸和氯化铜全部反应完,生成的是氯化钡,溶液中一定含有的溶质是BaCl2;
(4)生成氢氧化铜沉淀的质量为9.8g,设氯化铜的质量为x
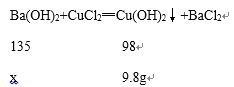
![]() x=13.5g。
x=13.5g。
所取溶液中含有氯化铜的质量为13.5g。

练习册系列答案
相关题目