题目内容
【题目】冰箱除味剂是利用活性炭制成的,某化学兴趣小组对冰箱除味剂的性质进行相关探究。
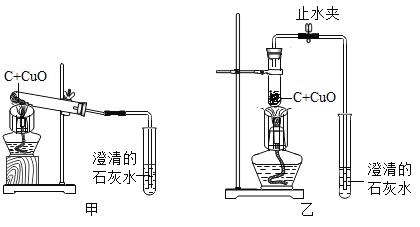
(1)图甲加热装置中发生反应的化学方程式为__________,为了提高加热温度,小组同学用如图的乙装置替代甲装置,你认为提高加热温度的方法还有_________________(答一种即可)。
(2)小组同学观察生成的红色固体,发现不同组的实验颜色有差异;为弄清这种红色固体的成分,进行了如下的探究:
[提出问题]反应后的红色固体成分是什么?
[查阅资料]纯净的Cu2O为鲜红色粉末状固体,几乎不溶于水,能与酸溶液发生反应,反应的化学方程式为:![]() 。
。
[猜想与假设]红色固体是:I.Cu II. Cu2O III._______。
[进行实验]
操作 | 现象 | 结论 |
取实验后的红色固体2. 16g于试管中,加入足量稀硫酸充分反应 | __________ | 红色固体定有Cu2O |
[解释与结论]小组内有同学认为猜想II正确,但同学们经过分析后认为这个结论不准确,因为无论红色固体中是否有铜,实验现象都一样,所以猜想II和III都有可能正确。
[反思与评价]要得出正确结论,还需要测定的数据是_______________,若用a表示该数据,则a的取值范围为______________,可以得出猜想III正确。
【答案】![]() 改用酒精喷灯加热或增加酒精的量(浓度)或调节灯芯的长短等 Cu和Cu2O的混合物 固体部分减少,溶液由无色变成蓝色 反应后固体质量 0.96 g < a < 2.16 g
改用酒精喷灯加热或增加酒精的量(浓度)或调节灯芯的长短等 Cu和Cu2O的混合物 固体部分减少,溶液由无色变成蓝色 反应后固体质量 0.96 g < a < 2.16 g
【解析】
(1)碳与氧化铜在高温条件下反应生成铜和二氧化碳。图甲加热装置中发生反应的化学方程式为![]() ,为了提高加热温度,小组同学用如图的乙装置替代甲装置,提高加热温度的方法还有改用酒精喷灯加热或增加酒精的量(浓度)或调节灯芯的长短等;
,为了提高加热温度,小组同学用如图的乙装置替代甲装置,提高加热温度的方法还有改用酒精喷灯加热或增加酒精的量(浓度)或调节灯芯的长短等;
(2)[猜想与假设]
红色固体是:I Cu II Cu2O III Cu和Cu2O的混合物
[进行实验]:
根据“纯净的Cu2O为鲜红色粉末状固体,几乎不溶于水,能与酸溶液发生反应,反应的化学方程式为:![]() 。”可知:
。”可知:
操作 | 现象 | 结论 |
取实验后的红色固体2. 16g于试管中,加入足量稀硫酸充分反应 | 固体部分减少,溶液由无色变成蓝色 | 红色固体定有Cu2O |
要得出正确结论,还需要测定的数据是称量反应结束后剩余红色固体的质量;
如果红色固体都是铜,则a=2.16g;如果红色固体都是氧化亚铜,设反应生成铜的质量为x。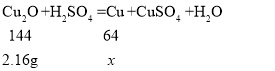
![]() x=0.96g,
x=0.96g,
如果猜想Ⅲ正确,则a的取值范围为0.96g<a<2.16g。