题目内容
过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,化学兴趣小组的同学将包有Na2O2固体的棉花放入如图1烧杯中,缓慢倒入CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.
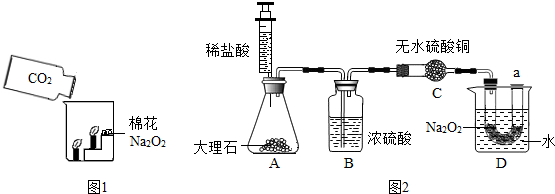
I.实验过程中“下位的蜡烛先熄灭,上位的后熄灭”的现象说明 二氧化碳具有的性质是 、 .
Ⅱ.棉花为什么会燃烧呢?小组同学联想起物质燃烧的相关知识,推理出棉花要燃烧,除了我们已知“棉花是可燃物”之外,还需满足的条件为 、 .
提出问题:在实验中是如何给棉花燃烧提供上述条件的呢?
查阅资料:2Na2O2+2CO2=Na2CO3+O2↑ 2Na2O2+2H2O=4NaOH+O2↑
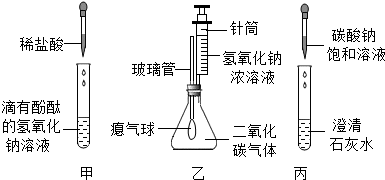
设计实验:经过讨论后,小组同学设计了如图2的实验进行探究.
(提示:浓硫酸有吸水性,白色无水硫酸铜遇水变蓝)
实验步骤:
(1)按如图2装配好装置,并检查整套装置气密性;具体查气密性方法是: ;
(2)将相关的试剂放入对应的仪器中;
(3)推动注射器的活塞,把稀盐酸注入锥形瓶内,并固定活塞位置;A中发生的反应方程式 ;
(4)一段时间后,在a处放置一根带火星的小木条,观察现象.
实验现象:
(1)C中干燥管中没有出现蓝色;
(2)a处带火星的小木条复燃;
(3)D处烧杯中水的温度升高.
实验分析:
(1)B装置的作用是 ;为什么要有此装置 ;
(2)C装置的作用是 ;
(3)D装置的烧杯内水温升高的原因是 .

I.实验过程中“下位的蜡烛先熄灭,上位的后熄灭”的现象说明 二氧化碳具有的性质是
Ⅱ.棉花为什么会燃烧呢?小组同学联想起物质燃烧的相关知识,推理出棉花要燃烧,除了我们已知“棉花是可燃物”之外,还需满足的条件为
提出问题:在实验中是如何给棉花燃烧提供上述条件的呢?
查阅资料:2Na2O2+2CO2=Na2CO3+O2↑ 2Na2O2+2H2O=4NaOH+O2↑
设计实验:经过讨论后,小组同学设计了如图2的实验进行探究.
(提示:浓硫酸有吸水性,白色无水硫酸铜遇水变蓝)
实验步骤:
(1)按如图2装配好装置,并检查整套装置气密性;具体查气密性方法是:
(2)将相关的试剂放入对应的仪器中;
(3)推动注射器的活塞,把稀盐酸注入锥形瓶内,并固定活塞位置;A中发生的反应方程式
(4)一段时间后,在a处放置一根带火星的小木条,观察现象.
实验现象:
(1)C中干燥管中没有出现蓝色;
(2)a处带火星的小木条复燃;
(3)D处烧杯中水的温度升高.
实验分析:
(1)B装置的作用是
(2)C装置的作用是
(3)D装置的烧杯内水温升高的原因是
考点:燃烧的条件与灭火原理探究,检查装置的气密性,气体的净化(除杂),二氧化碳的实验室制法,二氧化碳的物理性质,二氧化碳的化学性质,书写化学方程式、文字表达式、电离方程式,燃烧与燃烧的条件
专题:科学探究
分析:Ⅰ.实验过程:
二氧化碳灭火的原因:①二氧化碳的密度比空气大;②二氧化碳不能燃烧也不支持燃烧;
Ⅱ.可燃物燃烧的条件是:①与氧气接触;②达到可燃物的着火点;
实验步骤:(1)根据检查气密性的方法解答;
(3)盐酸与碳酸钙反应生成氯化钙和水和二氧化碳;
实验分析:
(1)大多数的固体物质的溶解度随着温度的升高而增大,而氢氧化钙的溶解度却随着温度升高而减小;
(2)浓硫酸具有吸水性,常用来干燥气体,硫酸铜遇水变蓝,常用来检验是否含有水蒸气;
实验结论:
(1)氧气能使带火星的木条复燃;
(2)据石灰水变浑浊可知溶液温度升高,Na2O2和CO2反应放热.
二氧化碳灭火的原因:①二氧化碳的密度比空气大;②二氧化碳不能燃烧也不支持燃烧;
Ⅱ.可燃物燃烧的条件是:①与氧气接触;②达到可燃物的着火点;
实验步骤:(1)根据检查气密性的方法解答;
(3)盐酸与碳酸钙反应生成氯化钙和水和二氧化碳;
实验分析:
(1)大多数的固体物质的溶解度随着温度的升高而增大,而氢氧化钙的溶解度却随着温度升高而减小;
(2)浓硫酸具有吸水性,常用来干燥气体,硫酸铜遇水变蓝,常用来检验是否含有水蒸气;
实验结论:
(1)氧气能使带火星的木条复燃;
(2)据石灰水变浑浊可知溶液温度升高,Na2O2和CO2反应放热.
解答:解:
实验过程:Ⅰ.
向烧杯中倒入二氧化碳,下面的蜡烛先熄灭,上面的蜡烛后熄灭,说明二氧化碳的密度比空气的密度大;二氧化碳接触火焰,没有燃烧起来,说明不能燃烧;蜡烛熄灭了,说明不能支持燃烧;
Ⅱ、物质燃烧需要三个条件:①物质是可燃物②与氧气接触③温度达到着火点.棉花是可燃物,还需要满足与氧气接触,温度达到着火点;
实验步骤:(1)查气密性方法是按如图2装配好装置,将C末端的导管放入水中,然后两只手紧握锥形瓶,看是否有气泡产生;
(3)推动注射器的活塞,把稀盐酸注入锥形瓶内,盐酸与碳酸钙反应生成氯化钙和水和二氧化碳;
实验分析:(1)从图1我们知道,Na2O2和CO2能发生反应,产生氧气,并放出了热量,棉花因有热量使温度达到着火点,就燃烧了起来.在图2中,Na2O2和CO2发生反应,放出热量使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体,从而使澄清石灰水变浑浊;
(2)B装置的作用是除去CO2中混有的水蒸气(或干燥气体),防止水与Na2O2反应生成氧气,造成干扰;C装置的作用是检验水蒸气是否除尽;
故答案为:
Ⅰ.密度比空气大,不可燃烧且不支持燃烧;
Ⅱ.与氧气接触,温度达到着火点;
实验步骤:(1)将C末端的导管放入水中,然后两只手紧握锥形瓶,看是否有气泡产生;
(3)CaCO3+2HCl═CaCl2+H2O+CO2↑.
实验分析:(1)除去CO2中混有的水蒸气(或干燥);防止水与Na2O2反应生成氧气,造成干扰;
(2)检验水蒸气是否除尽;
(3)Na2O2与CO2反应放出热量,使氢氧化钙溶液温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体;
实验过程:Ⅰ.
向烧杯中倒入二氧化碳,下面的蜡烛先熄灭,上面的蜡烛后熄灭,说明二氧化碳的密度比空气的密度大;二氧化碳接触火焰,没有燃烧起来,说明不能燃烧;蜡烛熄灭了,说明不能支持燃烧;
Ⅱ、物质燃烧需要三个条件:①物质是可燃物②与氧气接触③温度达到着火点.棉花是可燃物,还需要满足与氧气接触,温度达到着火点;
实验步骤:(1)查气密性方法是按如图2装配好装置,将C末端的导管放入水中,然后两只手紧握锥形瓶,看是否有气泡产生;
(3)推动注射器的活塞,把稀盐酸注入锥形瓶内,盐酸与碳酸钙反应生成氯化钙和水和二氧化碳;
实验分析:(1)从图1我们知道,Na2O2和CO2能发生反应,产生氧气,并放出了热量,棉花因有热量使温度达到着火点,就燃烧了起来.在图2中,Na2O2和CO2发生反应,放出热量使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体,从而使澄清石灰水变浑浊;
(2)B装置的作用是除去CO2中混有的水蒸气(或干燥气体),防止水与Na2O2反应生成氧气,造成干扰;C装置的作用是检验水蒸气是否除尽;
故答案为:
Ⅰ.密度比空气大,不可燃烧且不支持燃烧;
Ⅱ.与氧气接触,温度达到着火点;
实验步骤:(1)将C末端的导管放入水中,然后两只手紧握锥形瓶,看是否有气泡产生;
(3)CaCO3+2HCl═CaCl2+H2O+CO2↑.
实验分析:(1)除去CO2中混有的水蒸气(或干燥);防止水与Na2O2反应生成氧气,造成干扰;
(2)检验水蒸气是否除尽;
(3)Na2O2与CO2反应放出热量,使氢氧化钙溶液温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体;
点评:本题考查内容相对综合,涉及到的知识点有二氧化碳的性质、燃烧的条件、固体物质溶解度影响因素等,主要是运用基础知识去解决新的信息问题,这就要求学生学以致用,综合分析考虑.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列鉴别物质的方法中,切实可行的是( )
| A、用酚酞溶液鉴别NaCl溶液和盐酸 |
| B、用燃着的木条鉴别CO2和N2 |
| C、用石蕊溶液鉴别稀盐酸和稀硫酸 |
| D、用碳酸钠溶液鉴别澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液 |
 如图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质.
如图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质.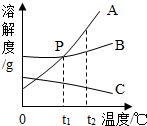 如图是A、B、C三种固体物质的溶解度曲线,请回答:
如图是A、B、C三种固体物质的溶解度曲线,请回答: