题目内容
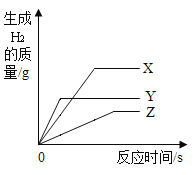
【题目】取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是
A. 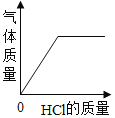 B.
B. 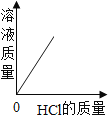 C.
C. 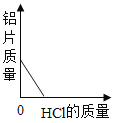 D.
D. 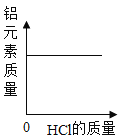
【答案】B
【解析】
A、向一定量的铝片中加入稀盐酸,随着盐酸的加入,氢气质量不断增大,至铝片完全反应后不再产生气体;图示正确;故不符合题意;
B、向一定量的铝片中加入稀盐酸,随着盐酸的加入,溶液的质量不断增大,铝元素反应后进入到溶液中,但由于又产生了氢气,其质量增大仍然较快,至铝片完全反应后不再产生气体;继续加入盐酸,溶液增加的质量只是盐酸溶液的质量,变化会比开始时变化更缓和一点;图示错误;故符合题意;
C、向一定量的铝片中加入稀盐酸,随着盐酸的加入,铝片不断反应,质量在不断减少,完全反应后铝片质量为零;图示正确;故不符合题意;
D、铝元素的质量是一定的,不管是否发生反应,其质量始终等于开始加进去的铝片的质量,图示正确;故不符合题意;
故选B

 口算能手系列答案
口算能手系列答案【题目】现有一包黑色固体粉末,可能含有炭粉、氧化铜、四氧化三铁中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(提出问题):该黑色固体粉末成分是什么?
(作出猜想):
猜想一:混合固体是炭粉、氧化铜 猜想二:混合固体是炭粉、四氧化三铁
猜想三:混合固体是氧化铜、 四氧化三铁 猜想四:混合固体是______
(查阅资料):
①Fe3O4能与盐酸反应
②含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色
③Fe(OH)2是一种白色沉淀,化学性质不稳定,最终转化为红褐色沉淀
(定性探究):
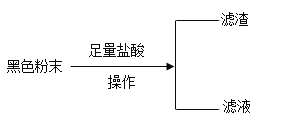
(1)在“操作”中需要用的玻璃仪器有:烧杯、玻璃棒、_____,玻璃棒的作用为_____,所得滤渣为______(填化学式);
(2)取滤液进行如下探究:(表格内填化学式)
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量的滤液于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体中一定没有____ |
步骤二:又取一定量的滤液于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液中一定含有的物质是______ |
步骤三:再取一定量的滤液于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最终全部变成红褐色 | 滤液中还一定含有的物质是___ |
(讨论交流):
(1)步骤三中滤液里加入氢氧化钠溶液产生红褐色沉淀化学方程式是_____;
(2)通过以上实验,猜想 ________成立;
(3)Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为____、____;
(4)现取该黑色粉末,经过以下操作,将该粉末中的铁元素全部转化为铁单质:步骤:_____。
(定量分析):
该化学兴趣小组取5g该黑色粉末,加入足量的盐酸后得到0.6g滤渣,则该黑色粉中的其他元素的质量分别是____?(写出计算过程,结果保留一位小数)
【题目】抗击“新型冠状病毒”用到的过氧乙酸(C2H4O3)是一种高效消毒剂。可由冰醋酸(C2H4O2)和双氧水在浓硫酸催化作用下制得,实验装置和步骤如下:
步骤1:在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;步骤2:不断搅拌并控制三颈烧瓶中混合液的温度为20~30℃至反应结束,在锥形瓶中收集产品。
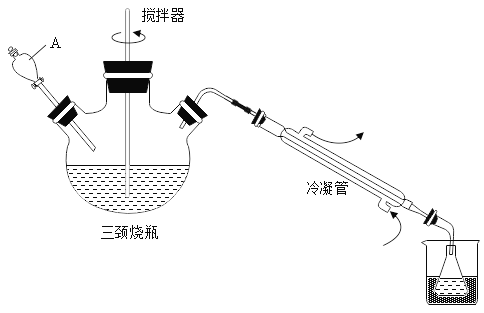
(1)仪器A的名称是_____
(2)步骤2搅拌的目的是_____
(3)下列关于过氧乙酸和冰酷酸的说法正确的是_____
a、过氧乙酸属于氧化物
b、过氧乙酸的相对分子质量为76
c、冰醋酸中C、H、O元素的质量比为6:1:8
d、过氧乙酸中氧元素的质量分数小于冰醋酸中氧元素的质量分数
(4)实验测得生成物过氧乙酸的质量分数随反应物比例![]() 和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
反应物比例 | 反应时间 | |||||
0.5h | 1h | 3h | 5h | 7h | ||
2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% | |
1:1 | 10.56% | 12.92% | 13.54% | 20.72% | 20.80% | |
1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% | |
(5)产品中过氧乙酸的质量分数的测定方法如下:取5.00g过氧乙酸产品,加水稀释成100g溶液;从取出5.00g溶液,先除去残余的H2O2,再加入稍过量的KI溶液,充分发生反应:C2H4O3+2KI+H2SO4=K2SO4+I2+C2H4O2+H2O,反应结束后,经实验测得生成I2的质量为0.127g,试计算原产品中过氧乙酸的质量分数。_____(写出计算过程,结果保留1位小数)。
(6)请根据你学过的“一定溶质质量分数溶液的配制”方法配制0.5%的过氧乙酸,用于地面、墙壁、门窗的消毒。
(实验用品)溶质质量分数为20%的过氧乙酸(密度为1.0261g/cm3)、水、1000mL量筒、10L塑料桶、木棒、口罩、眼镜、橡皮手套。
(实验步骤)①计算:将200mL20%的过氧乙酸(密度为1.026g/cm3)稀释为0.5%的过氧乙酸,需加入水的体积为_____mL(计算结果保留一位小数);
②配制:用量筒量取200mL20%的过氧乙酸倒入塑料桶中,按比例兑水,用木棒搅拌后,盖好桶盖待用。
(实验反思)
①由于过氧乙酸有腐蚀性,因此在配制溶液时要注意_____;
②在配制过氧乙酸过程中不能用铁器皿,原因是_____。