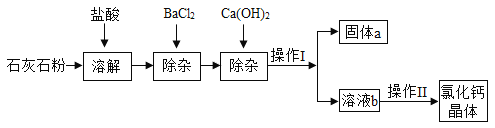
题目内容
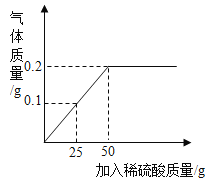
【题目】将颗粒大小相同的等质量X、Y、Z三种金属放入等浓度的稀盐酸中,产生氢气质量如图所示,下列说法正确的是
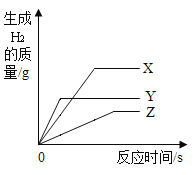
A.金属X最活泼
B.金属Y的相对原子质量一定大于X
C.若金属Z是Fe,则金属X一定不是Al
D.金属Z反应掉的稀盐酸一定最少
【答案】D
【解析】
由图像可知,金属活泼性:Y>X>Z;再结合利用一定量金属完全反应产生氢气质量等于![]() 可知X可能是铝,Y是镁,Z可能是锌或铁。
可知X可能是铝,Y是镁,Z可能是锌或铁。
A、由图像可知,Y金属的图像斜率最大,最活泼;故选项错误;
B、利用一定量金属完全反应产生氢气质量等于![]() ,要比较相对原子质量大小还需要已知三种金属的化合价,选项没有给出相关金属的化合价无法比较金属相对原子质量的大小;故选项错误;
,要比较相对原子质量大小还需要已知三种金属的化合价,选项没有给出相关金属的化合价无法比较金属相对原子质量的大小;故选项错误;
C、若金属Z是铁,则金属Y可以是镁,X是铝,因为等质量的镁和铝与足量的稀盐酸反应,铝产生的氢气多,但镁的金属活泼性强,产生的氢气速率快;故选项错误;
D、Z可能是锌或铁,等质量的锌(或铁)与足量的稀盐酸反应,消耗酸的质量小于等质量的镁和铝;故选项正确;
故选:D。

练习册系列答案
相关题目