题目内容
【题目】抗击“新型冠状病毒”用到的过氧乙酸(C2H4O3)是一种高效消毒剂。可由冰醋酸(C2H4O2)和双氧水在浓硫酸催化作用下制得,实验装置和步骤如下:
步骤1:在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;步骤2:不断搅拌并控制三颈烧瓶中混合液的温度为20~30℃至反应结束,在锥形瓶中收集产品。
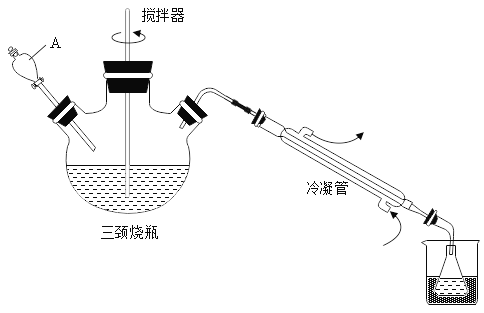
(1)仪器A的名称是_____
(2)步骤2搅拌的目的是_____
(3)下列关于过氧乙酸和冰酷酸的说法正确的是_____
a、过氧乙酸属于氧化物
b、过氧乙酸的相对分子质量为76
c、冰醋酸中C、H、O元素的质量比为6:1:8
d、过氧乙酸中氧元素的质量分数小于冰醋酸中氧元素的质量分数
(4)实验测得生成物过氧乙酸的质量分数随反应物比例![]() 和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
反应物比例 | 反应时间 | |||||
0.5h | 1h | 3h | 5h | 7h | ||
2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% | |
1:1 | 10.56% | 12.92% | 13.54% | 20.72% | 20.80% | |
1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% | |
(5)产品中过氧乙酸的质量分数的测定方法如下:取5.00g过氧乙酸产品,加水稀释成100g溶液;从取出5.00g溶液,先除去残余的H2O2,再加入稍过量的KI溶液,充分发生反应:C2H4O3+2KI+H2SO4=K2SO4+I2+C2H4O2+H2O,反应结束后,经实验测得生成I2的质量为0.127g,试计算原产品中过氧乙酸的质量分数。_____(写出计算过程,结果保留1位小数)。
(6)请根据你学过的“一定溶质质量分数溶液的配制”方法配制0.5%的过氧乙酸,用于地面、墙壁、门窗的消毒。
(实验用品)溶质质量分数为20%的过氧乙酸(密度为1.0261g/cm3)、水、1000mL量筒、10L塑料桶、木棒、口罩、眼镜、橡皮手套。
(实验步骤)①计算:将200mL20%的过氧乙酸(密度为1.026g/cm3)稀释为0.5%的过氧乙酸,需加入水的体积为_____mL(计算结果保留一位小数);
②配制:用量筒量取200mL20%的过氧乙酸倒入塑料桶中,按比例兑水,用木棒搅拌后,盖好桶盖待用。
(实验反思)
①由于过氧乙酸有腐蚀性,因此在配制溶液时要注意_____;
②在配制过氧乙酸过程中不能用铁器皿,原因是_____。
【答案】分液漏斗 使反应充分进行 bc 1:1 5h 15.2% 8002.8 戴手套、护目镜,作好防护措施 过氧乙酸会与铁发生反应
【解析】
(1)由图可知A为分液漏斗,故填:分液漏斗。
(2)步骤2搅拌的目的是使反应充分进行,故填:使反应充分进行。
(3)a、氧化物由两种元素组成,过氧乙酸由三种元素组成,不属于氧化物,a错。
b、过氧乙酸的相对分子质量为12×2+1×4+16×3=76,正确。
c、冰醋酸C2H4O2中C、H、O元素的质量比为12×2:4×1:16×2=6:1:8,正确。
d、过氧乙酸中氧元素的质量分数![]() ,冰醋酸中氧元素的质量分数
,冰醋酸中氧元素的质量分数![]() ,过氧乙酸中氧元素的质量分数大于冰醋酸中氧元素的质量分数,d错。
,过氧乙酸中氧元素的质量分数大于冰醋酸中氧元素的质量分数,d错。
故选:bc。
(4)由表中数据可知,反应物最佳比例是1:1;最佳反应时间约5h,故填:1:1;5h。
(5)解:设5g溶液中,过氧乙酸质量为x。

则100g溶液中过氧乙酸质量0.038g×20=0.76g,原产品中过氧乙酸的质量分数
![]()
故填:15.2%。
[实验步骤]①设:需要水的体积为y。200mL×1.026g/cm3×20%=(200mL×1.026g/cm3+y×1g/cm3)×0.5%,y=8002.8mL,故填:8002.8。
[实验反思]
①由于过氧乙酸有腐蚀性,因此在配制溶液时要注意戴手套、护目镜,作好防护措施。
②在配制过氧乙酸过程中不能用铁器皿,原因是过氧乙酸会与铁发生反应。
故填:戴手套、护目镜,作好防护措施;过氧乙酸会与铁发生反应。