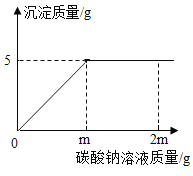
题目内容
【题目】如图所示,调节杠杆平衡后开始进行实验。
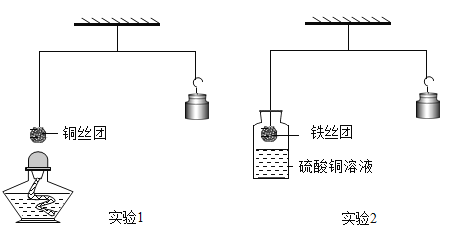
(1)实验1:加热细铜丝团一段时间后移走酒精灯,铜丝变为______色,观察到细铜丝团______(填“上升”、“下降”或“不变”),出现上述现象的原因是____________。
(2)实验2:将铁丝团浸入硫酸铜溶液一段时间,当观察到铁丝团有较多红色固体附着,小心地松手,发现稳定后的砝码比起始位置高, 写出瓶中反应的化学方程式_____________,基本反应类型是______。
【答案】黑 下降 铜与氧气反应,在表面生成质量更大的氧化铜 Fe+CuSO4=FeSO4+Cu 置换反应
【解析】
(1)铜与氧气在加热条件下反应生成氧化铜,根据质量守恒定律可知,氧化铜的质量等于参加反应的铜和氧气的质量。实验1:加热细铜丝团一段时间后移走酒精灯,铜丝变为黑色(CuO),质量增加,观察到细铜丝团下降,出现上述现象的原因是:Cu与氧气反应,在表面生成质量更大的CuO。
(2)铁与硫酸铜反应生成硫酸亚铁和铜。铁与硫酸铜溶液反应时,生成的铜覆盖在铁的表面。实验2:将铁丝团浸入硫酸铜溶液一段时间,当观察到铁丝团有较多红色固体附着,小心地松手,发现稳定后的砝码比起始位置高,原因是铁与硫酸铜反应置换出铜,生成铜的质量大于消耗铁的质量,故发生反应的化学方程式为Fe+CuSO4=FeSO4+Cu;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应。

 阅读快车系列答案
阅读快车系列答案【题目】下列归纳总结不完全正确的一组是( )
A.物质构成 | B.化学与生活 |
①氧气是由分子构成的 ②水银是由原子构成的 ③食盐是由离子构成的 | ① ②缺铁会贫血 ③缺维生素A会得夜盲症 |
C.物质分类 | D.油污处理 |
①合金属于混合物 ②纯碱属于氧化物 ③干冰属于有机物 | ①汽油除油污是溶解原理 ②洗涤剂除油污是乳化原理 ③炉具清洁剂用于除油污 |
A.AB.BC.CD.D
【题目】将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如表:
物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 13.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 1.0 | 7.2 | 8.8 | a |
下列判断错误的是( )
A. 该化学反应的反应物有两种
B. 表中a的值为2.8
C. X中含有氢元素
D. 该反应属于氧化反应