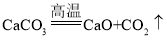题目内容
【题目】2019年为“元素周期表年”,元素周期表是学习和研究化学的重要工具.原子序数为1~18的元素在元素周期表中的位置如下表所示(如图)
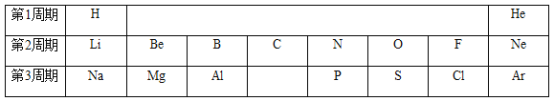
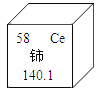
(1)①1869年发表元素周期表的科学家是_________,图1中空白处元素的元素符号为_________,写出其氧化物的化学式___________。
②钠离子的化学符号为_________,其核外电子数为___________。
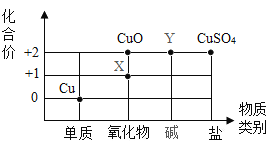
(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价一物质类别”的关系图(如图)。写出物质X的化学式:_______。
(3)下列的一个微粒具有和一个水分子相同的电子总数的是________(填字母序号)。
A H2S B Al3+ C OH– D CH4
【答案】门捷列夫 Si SiO2 Na+ 10 Cu2O BCD
【解析】
(1)①1869年发表元素周期表的科学家是门捷列夫,图中空白处元素的元素符号为Si,硅的氧化物是二氧化硅,二氧化硅中氧元素显-2价,硅元素显+4价,根据化合物中各元素的化合价代数和为零,其化学式为SiO2;
②钠离子带1个单位的正电荷,其化学符号为Na+,钠原子失去1个电子形成钠离子,其核外电子数为10;
(2)根据铜及其化合物的“化合价—物质类别”的关系图可知。物质X中铜元素化合价显+1价,根据化合物中各元素的化合价代数和为零,其氧化物的化学式为Cu2O;
(3)一个水分子的电子总数=1×2+8=10,1个H2S分子的电子总数=(1×2)+16=18, 1个Al3+的电子总数=13-3=10,一个OH–的电子总数=1+8+1=10,一个CH4的电子总数=6+(1×4)=10。故选BCD。

 名校课堂系列答案
名校课堂系列答案【题目】为测定某石灰石矿中碳酸钙的含量,兴趣小组同学称取 12.5g 石灰石矿样品粉末于烧杯中,将 80g 稀盐酸 分四次加入,充分反应,测得实验数据如下表所示(杂质不溶于水,也不参与反应,生成的气体全部逸出):
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸 的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余 物的质量 (g) | 30.5 | 48.5 | 68.1 | 88.1 |
(1)第_______次加入稀盐酸,样品中的碳酸钙就完全反应,生成__________g 二氧化碳。
(2)该石灰石矿中碳酸钙的质量分数为多少_______?(写出计算过程?)