题目内容
【题目】取10.0g碳酸钙高温加热,一段时间后停止加热,剩余固体中钙元素质量分数为50.0%.下列判断正确的是( )
A. 生成2.0g CO2气体
B. 剩余固体的质量为5.0g
C. 生成了5.6g CaO
D. 剩余CaCO3的质量为8.0g
【答案】A
【解析】
据化学变化前后元素质量不变,可得反应前后固体物质中钙元素的质量相等,由反应前碳酸钙中所含量钙元素的质量及反应后固体中钙元素的质量分数可计算反应后所得固体的质量,然后使用质量守恒定律,反应前后固体的质量差即为分解过程放出二氧化碳气体的质量。
原碳酸钙10g中的钙元素质量为:10g×![]() ×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=4g÷50%=8g,即剩余碳酸钙和生成氧化钙总量为8g,则剩余碳酸钙质量少于8g;
×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=4g÷50%=8g,即剩余碳酸钙和生成氧化钙总量为8g,则剩余碳酸钙质量少于8g;
根据质量守恒定律,反应生成二氧化碳的质量=10g﹣8g=2g;
设生成的氧化钙质量是x
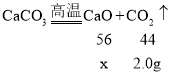
![]()
x≈2.56g
故选:A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目