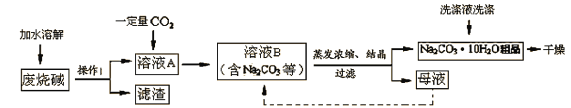
题目内容
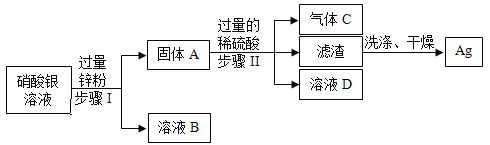
【题目】某化学实验室从含少量硝酸锌的硝酸银废液中提取贵金属Ag,其主要操作流程如图所示:
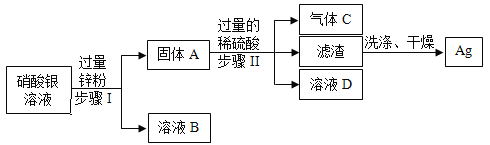
(1)固体A的成分有________________(填化学式)。
(2)写出步骤I中发生反应的化学方程式:_________________。
(3)若往溶液D中加入适量某种物质后,可得到只含一种溶质的溶液,则加入的物质可能是_________________。
【答案】Zn、Ag ![]() Zn(或ZnO)
Zn(或ZnO)
【解析】
(1)锌的金属活动性强于银,所以锌和硝酸银反应生成硝酸锌和银,由于是加入过量的锌粉,所以固体A的成分有剩余的Zn和生成的Ag;
(2)步骤I是锌和硝酸银反应生成硝酸锌和银,对应的化学反应方程式为Zn+2AgNO3=Zn(NO3)2+2Ag;
(3)步骤Ⅱ中,锌和稀硫酸反应生成硫酸锌和氢气,铜不和稀硫酸反应,过滤后,溶液D为硫酸锌和硫酸,加入适量的锌,可得到只含硫酸锌一种溶质的溶液。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】某实验小组的同学为了测定CaCl2和NaCl的混合物中CaCl2的含量,他们取样品25.8g于烧杯中,加入134.2g水全部溶解,再多次加入某Na2CO3溶液充分反应。加入Na2CO3溶液 与产生沉淀的质量如下表所示:
Na2CO3溶液/g | 10 | 10 | 10 | 10 | 10 | 10 |
沉淀质量/g | 5 | 10 | 15 | 20 | 20 | m |
(1)Na2CO3中钠、碳、氧三种元素的质量比为_____,表中m=_____。
(2)样品中CaCl2的质量是____;恰好完全反应时,所得溶液中溶质的质量分数是____。
【题目】酱油在使用及储藏过程中颜色会变深,逐渐降低品质。实验小组通过实验研究温度、氧气、光照3个因素对酱油颜色的影响。
(查阅资料)① 通过色差仪检测L*值可监控酱油颜色变化,酱油颜色越深,L*值越小。
② 保鲜瓶具有的特点是挤出盛放的物质后,空气不会进入。
(实验准备)
将等量样品(同品牌、同批次、初始L*值为43.82的酱油)分装到500 mL的不同容器中,密封。
(进行实验)
实验1:将装有样品的多个透明玻璃瓶置于不同温度的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。
编号 | 温度 | 15天 | 30天 | 45天 |
1-1 | 5 ℃ | 43.77 | 43.53 | 42.91 |
1-2 | 28 ℃ | 43.71 | 43.19 | 42.85 |
1-3 | 45 ℃ | 43.67 | 42.55 | 40.89 |
实验2:将装有样品的两个容器置于28 ℃的恒温箱中。每15天,分别倒出100 mL酱油,剩余样品放回恒温箱。用色差仪检测倒出样品的L*值,结果如下。
编号 | 容器 | 15天 | 30天 | 45天 |
2-1 | 透明玻璃瓶 | 43.45 | 42.36 | 41.30 |
2-2 | 透明保鲜瓶 | 43.72 | 42.98 | 42.53 |
实验3:将装有样品的多个容器置于28 ℃的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。

(解释与结论)
(1)实验1得出的结论是_____。
(2)实验2的目的是_____。
(3)实验3欲研究光照对酱油颜色的影响,应选用的容器是_____。
(4)家庭常使用透明玻璃瓶盛放酱油。解释“在相同时间内,使用过的酱油比未开封的酱油颜色深”可依据的实验是_____(填编号)。
(反思与评价)
(5)结合本实验,你对使用或储藏酱油的建议是_____。
(6)酱油在酿造过程中,有时会产生过量的铵盐(如NH4Cl)影响酱油的口感。可用碳酸钠除去铵盐,原理如下,补全该反应的化学方程式。Na2CO3 + 2NH4Cl === 2NaCl + 2NH3↑ + H2O +_____