题目内容
【题目】向氯化铜溶液中加入一定量的锌粉充分反应,下列情况中可能出现的是( )
①溶液中有Zn2+、Cu2+,不溶物为Cu ②溶液中有Zn2+、Cu2+,不溶物为Zn ③溶液中只有Zn2+,不溶物为Zn ④溶液中只有Zn2+,不溶物为Zn、Cu
A.①③
B.②③
C.①④
D.③④
【答案】C
【解析】本题考查了金属与盐溶液的反应.向氯化铜溶液中加入一定量的锌粉充分反应,可分为一.种情况:一、加入的锌不足,则溶液中有Zn2+、Cu2+,不溶物为Cu;二、加入的锌恰好与氯化铜完全反应,则溶液中有Zn2+,不溶物为Cu;三、加入的锌过量,则溶液中只有Zn2+,不溶物为Zn、Cu.综合上述三种情况,C对.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】 H2O2生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间。
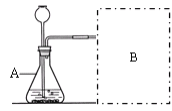
【进行实验】右下图是他们进行实验的装置图,此实验中B处宜采用的气体收集方法是: __________________。
【实验记录】
实验编号 | 1 | 2 |
反应物 | 6% H2O2 | 6% H2O2 |
催化剂 | 1g 红砖粉 | 1g MnO2 |
时间 | 152 s | 35 s |
【结论】该探究过程得出的结论是_______________________________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明MnO2和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____________和_____________是否改变。