题目内容
【题目】(12分)铁质水龙头长期使用容易生锈,小明从自家水龙头上取下一些铁锈样品,用下图所示的装置进行实验。

(1)B处澄清石灰水变浑浊,反应方程式为 ,C处酒精灯的作用是
(2)实验结束,小明将所得的黑色固体物质放入足量的稀硫酸中,发现没有气泡,这说明生成物中 (有或没有)铁。
为解释这个现象,小明查阅下列资料:
Ⅰ。已知铁的氧化物有FeO、Fe3O4、Fe2O3,,在一定条件下,均能逐步失去其中的氧,最终被还原为铁。
Ⅱ。某炼铁厂对氧化铁和一氧化碳进行热反应分析,获得相关数据并绘制成下图。
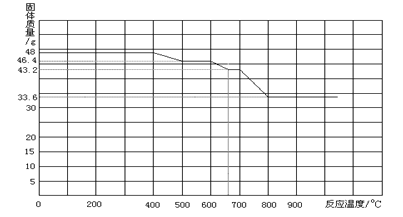
通过分析资料确定:
①700℃时氧化铁和一氧化碳进行反应的产物是 (填FeO或Fe3O4或Fe).
②小明实验失败的主要原因是 。
【答案】(1) CO2 + Ca(OH)2 = CaCO3↓+ H2O; 除尾气一氧化碳,防止对空气的污染 。(2)没有
① FeO; ②使用酒精灯加热氧化铁达不到完全反应所需的温度,
【解析】
试题分析:(1)B处澄清石灰水变浑浊,反应方程式为CO2 + Ca(OH)2 = CaCO3↓+ H2O; C处酒精灯的作用是除尾气一氧化碳,防止对空气的污染 。⑵铁是活泼金属,遇硫酸必产生气泡,题中告诉我们没有看到气泡,那只能说明没有生成铁。①由图知,700℃时,48g固体物质氧化铁反应生成固体物质43.2g。为确定43.2g到底是何成分,我们需知道铁元素与氧元素的质量比。首先,我们求铁元素质量。过程如下:
由于铁元素在反应前后守恒,故43.2g固体物质中铁元素质量与48g氧化铁中铁元素质量相等。质量为48g×112/160×100%=33.6g。
其次,我们求剩余固体中氧元素质量,过程如下:43.2-33.6=9.6g。
最后,我们求铁元素与氧元素的质量比:33.6∶9.6=56∶16,即其产物为FeO。
②根据题中有关结论,结合图中的提示,容易得出失败原因是温度低。

 阅读快车系列答案
阅读快车系列答案