题目内容
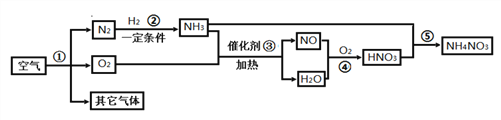
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”.其模拟流程如下:
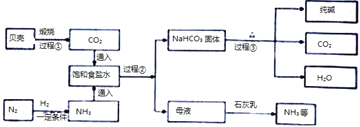
【小资料】
I、贝壳的主要成分是CaCO3
Ⅱ、通常情况下,1体积水中大约能溶解700体积氨气,1体积水中大约能溶解1体积二氧化碳
Ⅲ、饱和食盐水中发生的主要反应为:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(1)合成氨需要的氮气来自空气,空气属于________(填“混合物”或“纯净物”)。空气中氮气的体积分数约为____。
(2)过程②中主要操作的名称是___,用到的玻璃仪器有玻璃棒、烧杯、_______。
(3)过程①中发生反应的化学方程式为__,过程③中反应所属基本反应类型为___。
(4)为了提高产率,往饱和食盐水中通入气体时,你认为应该先通入___(填“NH3”或“CO2”),你的理由是:______________。
(5)上述流程中可以循环利用的物质是:______(填化学式,写一种即可)
【答案】 混合物; 78%; 过滤; 漏斗 CaCO3![]() CaO+CO2↑; 分解反应; NH3 因为氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠; CO2 、 NH3(合理即可).
CaO+CO2↑; 分解反应; NH3 因为氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠; CO2 、 NH3(合理即可).
【解析】本题以“侯氏制碱法”模拟流程图为情境,考查了过滤的原理、化学方程式的书写等。
(1)空气中含有氮气、氧气等多种气体,属于混合物,空气中氮气体积分数约为78%;
(2)过程②是将碳酸氢钠固体与氯化铵溶液分离,操作②的名称是过滤;用到的玻璃仪器有玻璃棒、烧杯、漏斗;
(3)过程①中发生反应是碳酸钙在高温条件下分解生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;过程中③中,碳酸氢钠分解生成碳酸钠、水和二氧化碳,属于分解反应;
CaO+CO2↑;过程中③中,碳酸氢钠分解生成碳酸钠、水和二氧化碳,属于分解反应;
(4)往饱和食盐水中通入气体时,应该先通入氨气,因为氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠;
(5)从反应过程看出将二氧化碳通过氨盐水制取碳酸氢钠和氯化铵,碳酸氢钠分解生成CO2,过程②得到母液与石灰乳能产生NH3,CO2 、 NH3可循环利用。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】将一定量的X和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | X | 氧气 | 水 | 二氧化碳 |
反应前质量/g | 4.6 | 10.6 | 1.6 | 1.2 |
反应后质量/g | a | 1.0 | 7.0 | 10.0 |
下列判断不正确的是
A. 表中a的值为0 B. 物质X一定是有机物
C. 反应中水和氧气的质量比是9:16 D. 物质X不含氧元素