题目内容
【题目】化学反应常伴随着能量的变化,从能量角度去认识化学变化是认识化学的重要手段。实验用品:37%的浓盐酸(密度为1.18g/mL)、10%的氢氧化钠溶液、蒸馏水量筒、温度计。
实验一:配制100mL 10%的盐酸(密度为1.05g/mL)
实验步骤:
(1)计算:需要37%的浓盐酸的体积为______mL(精确到0.01mL,下同):需要蒸馏水的体积为______mL(水的密度为10g/mL)
(2)量取浓盐酸和蒸馏水
(3)混合配制
实验二:在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸(室温下),反应中溶液温度的变化如下:
加入盐酸的体积(V)mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
溶液温度变化(△t)℃ | △t1 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
①表中△t1的值为______。
②写出该反应的化学方程式______。
③当加入盐酸的体积为10mL时,所得溶液的溶质一定含有______。
④根据上表分析,加入盐酸的体积在0~10mL,溶液温度变化的趋势及其原因是______。
⑤其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线的分析,大胆猜想新曲线最高点的位置(不考虑溶液密度和比热容的变化及热量散失等影响因素)______

【答案】24.05ml 76.62 0 NaOH+HCl=NaCl+H2O NaCl 溶液的温度不断升高,其原因是中和反应时放热反应 根据氢氧化钠和稀盐酸反应的方程式,浓度加倍溶质不变,体积应该减半
【解析】
(1)稀释前后溶质的质量不变,设需要37%的浓盐酸的体积为m,则37%×m×1.18g/mL=100mL×10%×1.05g/mL,解得m=24.05ml;水的质量为:100ml×1.05g/mL-24.05mL×1.18g/mL=76.62g,则水的体积=76.62ml÷1.0g/mL=76.62ml
(3)①反应还没进行,溶液的温度不变,所以是0;
②根据氢氧化钠和盐酸反应生成氯化钠和水,方程式为:NaOH+HCl=NaCl+H2O;
③氢氧化钠和稀盐酸反应,无论反应过量还是恰好完全反应,溶液中都会有氯化钠;
④根据表中数据可知,加入盐酸的体积在0~10mL,溶液的温度一直在增加,原因是氢氧化钠和稀盐酸反应属于中和反应,中和反应放出了热量,故填:溶液的温度不断升高,其原因是中和反应是放热反应;
⑤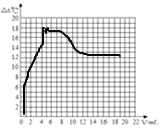
根据氢氧化钠和稀盐酸反应的方程式,浓度加倍溶质不变,体积应该减半。