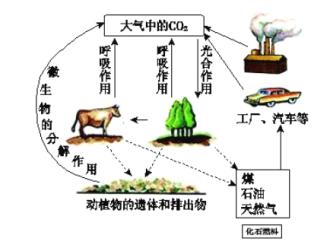
题目内容
【题目】在点燃条件下,4.8g CH4与16.0g O2恰好完全反应,生成10.8gH2O、4.4g CO2和物质X.则X的质量为_____g;化学方程式为_____。
【答案】5.6 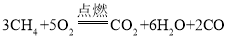
【解析】
根据质量守恒定律可知,反应前后质量总和不变,则有:4.8g+16.0g=10.8g+4.4g+X,解得X=5.6g;4.8g CH4中碳元素质量=![]() ,4.8g CH4中氢元素质量=4.8g-3.6g=1.2g;10.8gH2O中氧元素的质量=
,4.8g CH4中氢元素质量=4.8g-3.6g=1.2g;10.8gH2O中氧元素的质量=![]() ,10.8gH2O中氢元素的质量=10.8g-9.6g=1.2g;4.4g CO2中碳元素质量=
,10.8gH2O中氢元素的质量=10.8g-9.6g=1.2g;4.4g CO2中碳元素质量=![]() ,4.4g CO2中氧元素质量=4.4g-1.2g=3.2g;根据质量守恒定律可知X物质中碳元素的质量=3.6g-1.2g=2.4g,氢元素质量=1.2g-1.2g=0;氧元素质量=.16.0g—9.6g-3.2g=3.2g,X物质含有碳、氢元素,碳原子与氧原子的个数比=
,4.4g CO2中氧元素质量=4.4g-1.2g=3.2g;根据质量守恒定律可知X物质中碳元素的质量=3.6g-1.2g=2.4g,氢元素质量=1.2g-1.2g=0;氧元素质量=.16.0g—9.6g-3.2g=3.2g,X物质含有碳、氢元素,碳原子与氧原子的个数比=![]() ,所以在此条件下甲烷与氧气反应生成二氧化碳、一氧化碳和水,反应中,甲烷、氧气、二氧化碳、水和一氧化碳化学计量数比=
,所以在此条件下甲烷与氧气反应生成二氧化碳、一氧化碳和水,反应中,甲烷、氧气、二氧化碳、水和一氧化碳化学计量数比=![]() ,反应的化学方程式为:
,反应的化学方程式为:
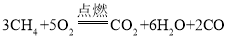 。
。

 小学课时特训系列答案
小学课时特训系列答案【题目】小习在玩“密室逃脱”的第一关中,就遇到了一道寻找7位数字的通关密码题目。请你来帮他解决难题。如图所示:墙上有一个这样的六边形图案,编号分别对应一种物质,已经在图上给出。通过寻找,小习找到的线索Ⅰ:在六边形中的8种物质,如果相邻的两种物质之间能发生化学反应时,它们对应的编号才能依次构成相邻的密码数字。Mg能H2SO4与发生反应,不能与NaOH和Na2CO3反应,所以密码顺序为:①③。
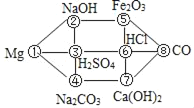
(1)请利用编号①﹣⑧位置上的物质,按照规则把缺失的通关密码依次补全:
① | ③ | ___ | ___ | ___ | ___ | ⑧ |
线索Ⅱ:(2)写出①和⑧两种物质参加的两个化学方程式:___;___。
线索Ⅲ:(3)选择一组物质,写出纯碱制烧碱的化学方程式:___;写一个中和反应的化学方程式:___; (写一个即可)。 祝贺你完成以上任务,获得开启第一间密室的钥匙。