题目内容
【题目】(7分)某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:
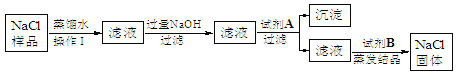
根据流程图回答:
(1)操作Ⅰ的名称是 ,加入的试剂A是 ,沉淀是 ;
(2)写出NaOH与杂质反应的化学方程式 ;(2分)
(3)加入试剂B的目的是 ;
(4)蒸发结晶时用到玻璃棒的作用是 。
【答案】(1)过滤 Na2CO3 CaCO3 (2)2NaOH +MgCl2=Mg(OH)2↓+2NaCl
(3)除去过量的Na2CO3、NaOH (4)搅拌,防止液体受热不均匀飞溅
【解析】
试题分析:(1)操作Ⅰ是将不溶性固体和液体分离,故名称是过滤;加入的试剂A的目的是除去NaCl中的杂质是氯化钙,故试剂A应为Na2CO3 ;发生的反应为: CaCl2+Na2CO3==CaCO3↓+2NaCl ,故沉淀是CaCO3
(2)加入NaOH是除去杂质氯化镁,反应的化学方程式:2NaOH +MgCl2=Mg(OH)2↓+2NaCl
(3)由于所加的氢氧化钠、碳酸钠都是过量的,故最终滤液中除了含有NaCl,还含有过量氢氧化钠、碳酸钠,所以加入试剂B的目的是:除去过量的Na2CO3、NaOH
(4)蒸发结晶时用到玻璃棒的作用是:搅拌,防止液体受热不均匀飞溅

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目