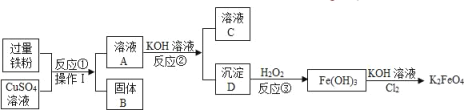
题目内容
【题目】化学实验课上,教师让同学们用实验台上五瓶无标签的无色溶液,探究酸碱盐之间的反应。五瓶无标签的无色溶液是:Na2CO3 溶液、NaCl 溶液、NaOH 溶液、Ca(OH)2 溶液、稀盐酸。
(1)甲同学用 A、B、C、D、E 给五瓶无标签的无色溶液编号,做两两混合实验,E与其他四种物质混合的实验现象记录如表:
A | B | C | D | |
E | 无现象 | 白色沉淀 | 无色气泡 | 无现象 |
由此实验确定 E 是_____(写化学式),还能确定_____,不能确定的无色溶液可用_____试剂鉴别。
(2)乙同学探究酸碱盐之间反应的实验如图所示。
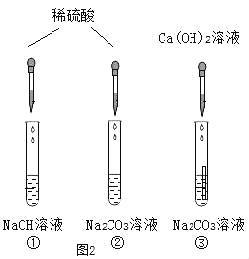
实验①中观察不到明显现象,不能判断反应有没有发生,乙同学是如何改进该实验的?_____,当观察到_____时,说明恰好完全反应,写出反应的化学方程式_____。根据②③实验,结合①的改进实验,可得出酸碱盐之间如果发生反应,要有_____生成。
(3)实验后,丙同学将①②③实验中的废液全部倒入同一只烧杯中,观察到先有气泡产生,后有白色沉淀,过滤得到无色溶液。则无色溶液中一定含有的溶质是_____;可能含有的溶质是_____;为确定可能含有的溶质,简单的实验方案设计是_____。
【答案】Na2CO3 Ca(OH)2、HCl 酚酞或紫色石蕊试液等 向 NaOH 溶液中滴加酚酞; 溶液由红色变为无色; NaOH+HCl→NaCl+H2O; H2O 或气体或沉淀 NaCl; CaCl2 或 Na2CO3; 取样,向其中滴加酚酞,溶液变红色则含有 Na2CO3,若无明显现象,再滴加Na2CO3 溶液,有白色沉淀生成则含有 CaCl2。
【解析】
I.根据实验现象记录可知,E与其他四种物质反应后,一个有白色沉淀,一个有气泡产生,两个无明显现象,可知E为Na2CO3 溶液符合情况;Na2CO3 溶液与氢氧化钙产生沉淀,Na2CO3 溶液与稀盐酸反应产生气体,Na2CO3溶液与NaCl溶液、NaOH溶液不反应,故无明显现象。NaCl溶液、NaOH溶液可以采用紫色石蕊或者酚酞来鉴别;故填:Na2CO3;Ca(OH)2、HCl;酚酞或紫色石蕊试液
II.稀盐酸与氢氧化钠反应无明显的现象,可以先向氢氧化钠溶液中滴加酚酞,开始时为红色,逐渐反应后,颜色由红色变为无色,说明已经发生了反应。其化学方程式为:NaOH+HCl→NaCl+H2O;根据②③实验,②反应生成二氧化碳气体和水;③反应生成碳酸钙沉淀,结合①反应生成水,可得出酸碱盐之间如果要发生反应,要有H2O或气体或沉淀生成,这是复分解反应的条件。故填:向NaOH 溶液中滴加酚酞;溶液由红色变为无色; NaOH+HCl→NaCl+H2O;H2O 或气体或沉淀
III.实验后,丙同学将①②③实验中的废液全部倒入同一只烧杯中,观察到先有气泡产生,说明一开始肯定有盐酸和碳酸钠剩余,后有白色沉淀产生,说明盐酸和碳酸钠反应后碳酸钠有剩余,碳酸钠和氯化钙反应生成碳酸钙沉淀,过滤得到无色溶液,无色溶液中一定含有的溶质是氯化钠,因为碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,且①②反应中也会有氯化钠产生;碳酸钠和氯化钙反应中存在三种情况,氯化钙过量,刚好完全反应,碳酸钠过量,故在可能含有的溶质是CaCl2 或 Na2CO3;为确定可能含有的溶质CaCl2 或 Na2CO3,可以用如下实验来检验:取样,向其中滴加酚酞,溶液变红色则含有 Na2CO3,若无明显现象,再滴加Na2CO3 溶液,有白色沉淀生成则含有 CaCl2。故填:NaCl; CaCl2 或 Na2CO3;取样,向其中滴加酚酞,溶液变红色则含有 Na2CO3,若无明显现象,再滴加Na2CO3 溶液,有白色沉淀生成则含有 CaCl2。

【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:
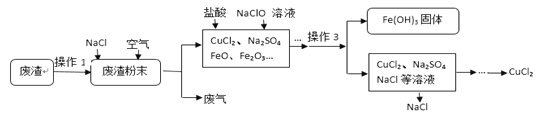
(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。