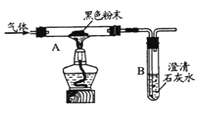
题目内容
【题目】用金属 铁制备自来水新型消毒、净水剂K2FeO4的流程如图,请回答下列问题:
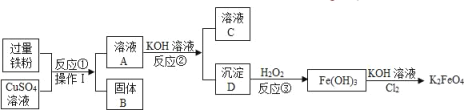
(1)溶液A的溶质是_____(写名称);写出K2FeO4中铁元素的化合价_____.
(2)操作Ⅰ的名称是_____;反应②的反应类型为_____.
(3)固体B属于_____(填“混合物”或“纯净物”).
(4)反应③中沉淀与H2O2发生化合反应,反应的化学方程式为_____.
【答案】硫酸亚铁 +6 过滤 复分解反应 混合物 2Fe(OH)2+H2O2 = 2Fe(OH)3
【解析】
(1)由反应的流程可知,过量的铁粉与硫酸铜反应,生成了硫酸亚铁和铜,由于铁是过量的,在过滤后得到的固体B是Cu,Fe的混合物;在K2FeO4中,由于钾元素显+1价、氧显-2价,设铁的化合价为x,由化合价原则可知:(+1)×2+x+(-2×4)=0,解得:x=+6;
(2)由上述反应①得到是固液的混合物,要将固液分开,应进行的操作是过滤,反应②应为硫酸亚铁和氢氧化钾反应,属于复分解反应;
(3)由反应的流程可知,过量的铁粉与硫酸铜反应,生成了硫酸亚铁和铜,由于铁是过量的,在过滤后得到的固体B是Cu,Fe的混合物;
(4)反应③是氢氧化亚铁与过氧化氢反应生成氢氧化铁,方程式是:2Fe(OH)2+H2O2=2Fe(OH)3。

 阅读快车系列答案
阅读快车系列答案【题目】牙膏是一种日用必需品。某研究性学习小组对某一品牌牙膏中所含摩擦剂的成分进行了如下探究。
[查阅资料]
(1)牙膏常用氢氧化铝、碳酸钙、二氧化硅等物质作摩擦剂,牙膏中其它成分遇到盐酸时无气体生成;SiO2不溶于水也不与盐酸反应。
(2)氢氧化铝是两性氢氧化物,在常温下它既能与强酸,又能与强碱反应。如与氢氧化钠可发生如下反应:Al(OH)3+NaOH=NaAlO2+2H2O.(NaAlO2溶于水)
[提出问题]该品牌牙膏的酸碱性如何?其中含有什么摩擦剂?
[实验与猜想]
(1)取少量牙膏膏体于小烧杯中,加入10毫升蒸馏水,充分搅拌,静置一段时间,分离上层清液和沉淀,待用;
(2)用pH试纸测定所得溶液的pH大于7,正确的操作方法是_____。
(3)取少量沉淀物加入过量的稀盐酸,沉淀物全部溶解并有大量气泡产生,同时得到澄清溶液A,则该品牌牙膏中一定含有碳酸钙,一定不含有_____。
(4)进行猜想:摩擦剂成分可能是a。只含碳酸钙 b._____。
[设计实验]
实验步骤 | 实验现象 | 解释与结论 |
取澄清溶液A逐滴滴入一定量氢氧化钠溶液 | 开始无明显现象,后产生白色沉淀 | 原因是1._____,2._____。(用化学方程式表示) |
继续滴入氢氧化钠溶液直至过量 | _____ | 摩擦剂中还含有_____ |
[实验结论]该品牌牙膏所含摩擦剂的成分猜想b正确。
【题目】化学实验课上,教师让同学们用实验台上五瓶无标签的无色溶液,探究酸碱盐之间的反应。五瓶无标签的无色溶液是:Na2CO3 溶液、NaCl 溶液、NaOH 溶液、Ca(OH)2 溶液、稀盐酸。
(1)甲同学用 A、B、C、D、E 给五瓶无标签的无色溶液编号,做两两混合实验,E与其他四种物质混合的实验现象记录如表:
A | B | C | D | |
E | 无现象 | 白色沉淀 | 无色气泡 | 无现象 |
由此实验确定 E 是_____(写化学式),还能确定_____,不能确定的无色溶液可用_____试剂鉴别。
(2)乙同学探究酸碱盐之间反应的实验如图所示。
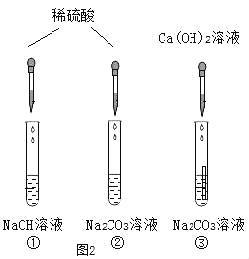
实验①中观察不到明显现象,不能判断反应有没有发生,乙同学是如何改进该实验的?_____,当观察到_____时,说明恰好完全反应,写出反应的化学方程式_____。根据②③实验,结合①的改进实验,可得出酸碱盐之间如果发生反应,要有_____生成。
(3)实验后,丙同学将①②③实验中的废液全部倒入同一只烧杯中,观察到先有气泡产生,后有白色沉淀,过滤得到无色溶液。则无色溶液中一定含有的溶质是_____;可能含有的溶质是_____;为确定可能含有的溶质,简单的实验方案设计是_____。