题目内容
【题目】硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
Ⅰ.挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到________,是由于挥发出来的硝酸蒸体遇到空气里的水蒸气形成硝酸小液滴的缘故。
Ⅱ.不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体。
(1)硝酸分解的化学方程式为:4HNO3 ![]() 4NO↑+O↑+_____。
4NO↑+O↑+_____。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
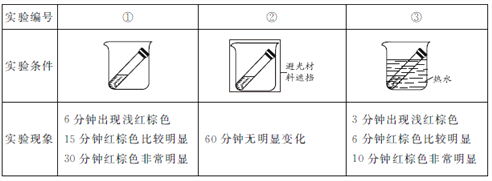
(2)实验①、②对比是研究______对浓硝酸稳定性的影响。
(3)实验①、③对比可得出的结论是_______。
Ⅲ.酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是_______。
IV .氧化性
(查阅资料3) 浓硝酸在加热条件下能与木炭发生反应:C+4HNO(浓) ![]() 4NO↑+CO↑+2H2O。
4NO↑+CO↑+2H2O。
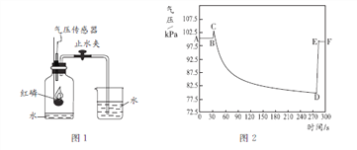
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能有________。

【答案】 白雾 2H2O 光 在光照等其他条件相同时,温度越高,硝酸分解越快 黑色粉末溶解,溶液显蓝色 挥发出来的硝酸蒸气与红热的木炭反应生成二氧化氮(或挥发出来的硝酸蒸气受热分解生成二氧化氮)
【解析】Ⅰ.【实验1】盛浓硝酸的试剂瓶,打开瓶塞,瓶口会出现白雾。和浓盐酸的性质类似Ⅱ.(1)化学反应前后各种原子个数相等。(2)做对比实验必须控制变量,根据题干信息查阅资料中,浓硝酸分解因素包括光和热,实验①无避光材料遮挡,而实验②有避光材料遮挡,温度相同,所以实验①、②对比是研究光对浓硝酸稳定性的影响。(3)实验①为26℃,而实验③放入热水中,温度较高,其它条件相同,所以实验①、③对比可得出的结论是在光照等其他条件相同时,温度越高,硝酸分解越快。Ⅲ.【实验3】因为硝酸能够与金属氧化物反应生成盐和水,所以氧化铜粉末与硝酸反应生成铜盐和水,含铜离子的溶液是蓝色,氧化铜粉末与硝酸反应的实验现象是黑色粉末溶解,溶液显蓝色。IV .【实验4】硝酸具有挥发性,挥发出来的硝酸蒸气与红热的木炭反应生成红棕色的二氧化氮。