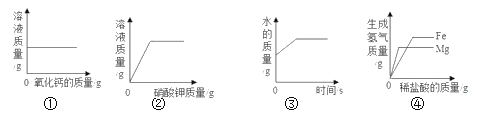
题目内容
【题目】通常情况下铜不与稀硫酸反应,但将一小块铜片加入装有过量稀硫酸的烧杯中,在不断通入O2并加热的条件下,可以发生如下反应:2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2X,下列说法正确的是( )
2CuSO4+2X,下列说法正确的是( )
A. 反应后烧杯中的物质只含有CuSO4和H2O
B. 生成物X的化学式是H2O2
C. 反应后溶液由无色变为蓝色
D. 反应前后烧杯内液体的质量不变
【答案】C
【解析】
由质量守恒定律反应前后原子的种类和数目不变进行分析,反应前铜原子的数目是2个,氢原子的数目是4个,氧原子的数目是10个,硫原子的数目是2个,反应后铜原子的个数是2个,硫原子的个数是2个,氧原子的个数是8个,所以X是H2O,
A、反应后烧杯中的物质含有生成的CuSO4和H2O,还有过量的稀硫酸,故选项不正确;
B、生成物X的化学式是H2O,故选项不正确;
C、稀硫酸溶液是无色的,反应生成的硫酸铜是蓝色的,反应后溶液由无色变为蓝色,故选项正确;
D、反应物中有气体参加,反应前后烧杯内液体的质量增加,故选项不正确。

 计算高手系列答案
计算高手系列答案【题目】某化学兴趣小组同学往NaOH溶液中滴加无色酚酞溶液时,发现溶液变成红色,可是过了一会儿红色消失,重新恢复为无色。于是该小组在老师指导下对这一现象进行了探究。
(提出问题)溶液的红色为什么会变成无色呢?
(猜想与假设)
猜想一:可能是所用的酚酞溶液变质了
猜想二:可能是NaOH与空气中的CO2反应了
猜想三:可能是酚酞与空气中的O2反应了
猜想四:可能是与NaOH溶液浓度大小有关
(查阅资料)Na2CO3俗称纯碱,是一种发酵剂, Na2CO3溶液的pH值通常约为10~11.9
(讨论交流)
(1)写出氢氧化钠在空气中变质的化学方程式:__________ 。
(2)对于猜想一,大家认为是错误的。往氢氧化钠溶液中滴加酚酞溶液时,发现溶液变成了红色,说明所用酚酞没变质。
(3)小组同学集体讨论后认为猜想二 ______(填“合理”或“不合理”),原因是______。
(设计并实验)
(1)为了验证猜想三,小组同学进行了如下实验:先向如图装有该NaOH溶液的试管中,从b处通入密度比空气大的稀有气体,将试管内的空气排尽。然后通过注射器滴入无色酚酞溶液,观察到溶液变成红色,过一会儿红色仍然消失。则猜想三______(填“正确”或“错误”)。

(2)为了验证猜想四,小组同学继续进行实验探究,并得出了实验结论,请你帮助该小组完成下表:
实验操作 | 实验现象 | 实验结论 |
在两支同样大小的试管中,分别加入等体积的质量分数为5%的氢氧化钠溶液和10%的氢氧化钠溶液,然后分别滴加1﹣2滴酚酞试液; | 5%的氢氧化钠溶液中红色不消失,10%的氢氧化钠溶液中先变红色,然后红色消失 | 猜想四__ (填“正确”或“错误”) |
(拓展延伸)
小组同学百度“酚酞”得知,酚酞(用H2In表示)其实是一种极弱的酸,遇碱溶液变红的变化可表示为:H2In(无色)![]() In2-(红色),据此信息写出H2In遇NaOH溶液变红的化学反应方程式为_____________。
In2-(红色),据此信息写出H2In遇NaOH溶液变红的化学反应方程式为_____________。
【题目】为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案。方案甲:称得生锈铁片的质量为 m1g,按图 I 所示装置进行实验。完全反应后,测得室温下产生氢气的体积为 V1L,查得其密度为p1g/L。方案乙:称得生锈铁片的质量为 m2g,先按图Ⅱ所示装置进行实验。当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温。取出铁片,按图 I 所示装置继续进行实验。完全反应后,测得室温下产生氢气的体积为 V2L,查得其密度为 p2g/L。
已知:Fe2O3+6HCl=2FeCl3+3H2O(FeCl3可溶于水)
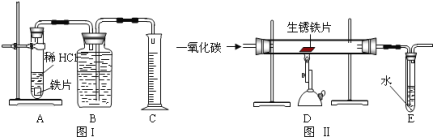
(1)铁锈的成分是__________.
(2)(评价交流)上述两个方案中,可行的是____(填“甲”或“乙”);分析不可行方案,其缺陷是____________________。
(3)(设计实验)方案乙中,同学们设计了如下实验报告,请帮助完成表中空格。
实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
①装置Ⅱ | 通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 | CO具有______性; 化学方程式:_______ |
②装置Ⅰ | 将光亮铁片放入稀盐酸中,完全反应 | ______ |
(4)图Ⅱ所示装置有缺陷,应如何改进__________。
(5)(结论)生锈铁片中铁元素的质量分数是_________(用字母表示)。
(6)(发散)实验室经常用一氧化碳来炼铁,实验室炼的铁和工业炼的铁本质区别是_______________