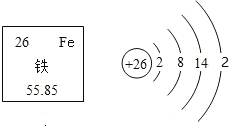
题目内容
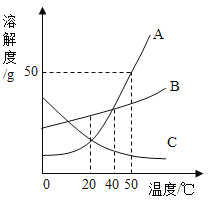
【题目】向盛有一定质量稀硫酸的烧杯中逐渐加入10g锌粒(已知Zn + H2SO4=ZnSO4+H2↑),产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:

(1)稀硫酸反应完时,产生氢气的质量为 ________g
(2)计算消耗锌粒的质量(写出计算过程) ________。
(3)计算原稀硫酸溶液的质量 ________。
【答案】0.2g 6.5g 100g
【解析】
(1)由图中数据可知,稀硫酸反应完时,产生氢气的质量为0.2g;
(2)设消耗锌粒质量为x,反应的硫酸质量为y,

![]()
解得x=6.5g
原稀硫酸溶液的质量为:109.8g+0.2g-10g=100g

练习册系列答案
相关题目