题目内容
【题目】高铁酸钾(K2FeO4)是一种新型多功能水处理剂,下图为制取高铁酸钾的工艺流程,请根据图示回答下列问题:
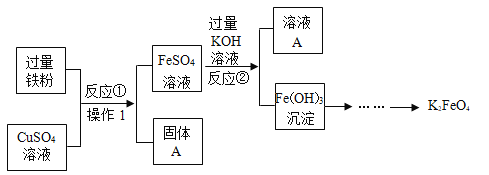
(1)写出反应①的化学方程式_____。
(2)操作1的名称是_____,高铁酸钾(K2FeO4)中Fe的化合价为_____。
(3)固体A中含有的物质是_____,写出溶液A中K2SO4的一种用途_____。
【答案】Fe+CuSO4=FeSO4+Cu 过滤 +6 铁和铜(Fe和Cu) 制作钾肥
【解析】
(1)反应①中铁粉与硫酸铜反应产生硫酸亚铁和铜的化学方程式:Fe+CuSO4=FeSO4+Cu;
(2)操作1将溶液与固体分离,名称是过滤,
解:设高铁酸钾(K2FeO4)中Fe的化合价为x,
(+1)×2+x+(-2)×4=0,x=+6;
高铁酸钾(K2FeO4)中铁元素化合价为+6价;
(3)反应①中过量的铁粉与硫酸铜反应产生硫酸亚铁和铜,铁粉有剩余,固体A中含有的物质是铁和铜,溶液A中K2SO4溶液中含有钾元素,可用作钾肥。

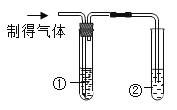
【题目】某化学兴趣小组同学用大理石和盐酸反应制取 CO2,将制得的气体通入新制的饱和澄清石灰水时,发现有气泡冒出,但一段时间后仍不变浑浊, 对此展开了探究活动 。
(提出问题)澄清石灰水未变浑浊的原因是什么?
(猜想与假设)I.制得气体中无 CO2 II.与盐酸的浓度有关
(进行实验)
实验1:小组同学取等量原试剂瓶中澄清石灰水于试管内进行实验
实验操作 | 现象 | 初步结论 |
| 试管1澄清石灰水未变浑浊 试管2澄清石灰水浑浊 | 可知猜想I不成立。 (1)写出试管中②发生的化学反应方程式_____ |
实验2:依据实验1结论,深入探究
实验序号 | ① | ② | ③ | ④ | ⑤ |
大理石质量(g) | 10 | 10 | 10 | 10 | 10 |
盐酸质量分数(%) | 37.5 | 20.3 | 13.9 | x | 8.5 |
盐酸体积(mL) | 10 | 10 | 10 | 10 | 10 |
将产生的气体通入5 mL新制饱和澄清石灰水中的现象 | 无 | 无 | 出现浑浊 | 出现浑浊 | 出现浑浊 |
实验3 :6个 125mL集气瓶中分别充入不同体积CO2 进行实验
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
CO2体积(mL) | 5 | 25 | 50 | 75 | 100 | 125 |
加入5 mL饱和澄清石灰水振荡5次现象 | 澄清 | 变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 |
振荡30次后现象 | 澄清 | 浑浊 | 浑浊 | 浑浊 | 澄清 | 澄清 |
(解释与结论)
(2)实验2的目的是_________。
(3)实验2表格中x的取值范围是________。实验2证明猜想II成立。
(4)分析实验3表格,你认为影响该实验现象的因素有_______。
(拓展)(5)查阅资料:碳酸钙的浊液能与二氧化碳反应生成能溶于水的碳酸氢钙(Ca(HCO3)2)写出⑥中从浑浊变澄清的化学方程式_______。
【题目】质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题。
(1)化学反应前后肯定没有变化的是_____(填序号)。
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
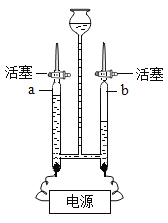
(2)请回忆你学习过的“质量守恒定律”的实验探究,并按要求完成实验方案一和实验方案二。
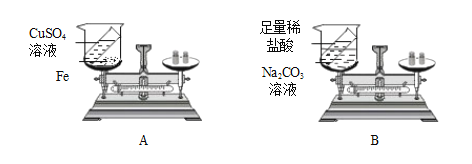
(下表中“实验结论分析”选填“=”“>”或“<”符号)
实验方案 | 方案一(A图) | 方案二(B图) |
反应现象 | 铁钉表面有红色固体生成,溶液由蓝色变成浅绿色 | _____ . |
反应前的总质量 | m1 | n1 |
反应后的总质量 | m2 | n2 |
实验结论分析 | m1_____ m2 | n1_____ n2 |
将两个实验结果进行讨论对比时,有同学分析:有一个方案观察到天平不平衡.其原因是_____;在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是_____。
(3)有同学认为白糖和水混合前后的质量也相等,说明该实验也能验证质量守恒定律,这种说法对吗,为什么?_____。