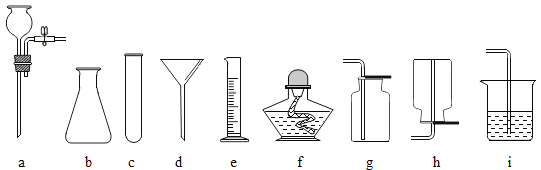
题目内容
【题目】用适当的化学用语填空
(1) 2个氢离子_____;
(2)硫离子_____;
(3)氦气_____;
(4)硫酸根离子_____;
(5)五氧化二磷_____;
(6)高锰酸钾_____;
(7)硝酸铁_____;
(8)氢氧化镁_____;
(9)标出硝酸铵中氮元素的化合价_____;
(10)标出过氧化氢中氧元素的化合价_____。
【答案】2H+ S2- He SO42- P2O5 KMnO4 Fe(NO3)3 Mg(OH)2 ![]()
![]()
【解析】
(1)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其元素符号前加上相应的数字;因此2个氢离子表示为:2H+,故填写为:2H+;
(2)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,因此硫离子表示为:S2-,故填写:S2-;
(3)氦气是由氦原子构成,氦原子的符号与氦元素相同,故填写:He;
(4)因硫酸根离子带2个单位的负电荷,则在硫酸根的右上角标“2-”可表示带2个单位的负电荷,因此硫酸根离子表示为:SO42-,故填写:SO42-;
(5)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写,因此五氧化二磷的化学式为:P2O5,故填写:P2O5;
(6)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写,因此高锰酸钾的化学式为:KMnO4,故填写:KMnO4;
(7)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写,硝酸铁中铁元素的化合价为:+3,因此硝酸铁的化学式为:Fe(NO3)3,故填写:Fe(NO3)3;
(8)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写,因此氢氧化镁的化学式为:Mg(OH)2,故填写:Mg(OH)2;
(9)硝酸铵中铵根离子显+1价,其中氢元素显+1价,氮元素显-3价,硝酸根离子显-1价,其中氧元素显-2价,氮元素显+5价,硝酸铵化学式为NH4NO3,由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,因此,硝酸铵中氮元素的化合价可表示为:![]() ,故填写:
,故填写:![]() ;
;
(10)过氧化氢中氢元素显+1价,氧元素显-1价,其化学式为H2O2;由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,因此,过氧化氢中氧元素的化合价可表示为:![]() ,故填写:
,故填写:![]() 。
。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】对比实验和控制变量法是化学中常用的探究问题和分析解决问题的科学方法。
(1)20℃时,某实验小组取不同质量的硝酸钾,分别加入到100g水中,充分溶解后,所得溶液的质量与加入硝酸钾的质量对应关系如表:
实验一 | 实验二 | 实验三 | 实验四 | |
硝酸押钾的质量/g | 20.0 | 25.0 | 30.0 | 35.0 |
所得溶液的质量/g | 120.0 | 125.0 | 130.0 | 131.6 |
①根据上表数据,实验二所得的溶液为____________(填“饱和溶液”或“不饱和溶液”)。
②若想要观察到实验四的35g硝酸钾全部溶解于水中,可采取的方法是__________。
(2)如图是氢分子和氧分子运动的示意图。
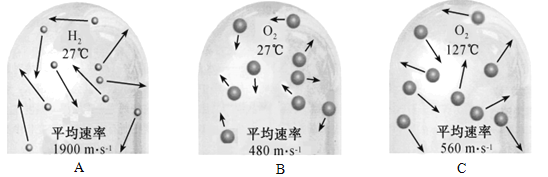
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是__________(填字母序号)。
②从图中可见,影响分子运动速率的因素除温度外,还与__________有关。
【题目】工业上常利用石灰浆(主要成分为Ca(OH)2)制备化工原料KClO3,流程如下:

(资料)有关物质在20摄氏度时的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
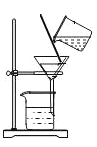
(1)操作a的名称是_____,在实验室中完成此操作需要的玻璃仪器有烧杯、玻璃棒、_____,玻璃棒是作用是_____。
(2)反应1向石灰浆中通入Cl2,得到Ca(ClO3)2、CaCl2的混合溶液。化学方程式中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此化学方程式_____。
(3)提高Cl2转化为Ca(ClO3)2的转化率的可行措施有_____(填序号)。
A 适当加大通入Cl2的速率
B 充分搅拌浆料
C 加水使Ca(OH)2完全溶解
D 加热
(4)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和_____(填化学式),你认为该反应能得到KClO3晶体的原因是_____。
(5)洗涤KClO3晶体时,可选用_____(填序号)。
A 饱和KCl溶液
B 饱和CaCl2溶液
C 饱和KClO3溶液